Benzil of C14H10O2 is een gele kristallijne organische verbinding die wordt gebruikt als voorloper bij de synthese van kleurstoffen en als foto-initiator in de polymeerchemie. Het kan ook als reductiemiddel werken en is een tussenproduct bij de vorming van benzilzuur.
| IUPAC-naam | 1,2-difenyl-1,2-dicarboxyethyleen |
| Moleculaire formule | C14H10O2 |
| CAS-nummer | 134-81-6 |
| Synoniemen | 1,2-Difenyl-1,2-propaandion, 1,2-Difenylethaandion, Benzilum, Benzil |
| InChi | InChI=1S/C14H10O2/c15-13(14(16)17)11-6-8-12(9-7-11)10-5-3-1-2-4-6/h1-9H,10- 17H2 |
Benzylmolecuulgewicht
Het molecuulgewicht van benzil is 210,24 g/mol. Het is de som van de atoommassa’s van alle atomen in een benzilmolecuul. Het molecuulgewicht van benzil wordt berekend op basis van de molecuulformule C14H10O2.
Benzile-dichtheid g/ml
De dichtheid van benzil is 1,20 g/ml. Het is de meting van de massa per volume-eenheid van een stof. De dichtheid van Benzil is relatief laag, waardoor het gemakkelijker te hanteren is in vergelijking met andere stoffen met een hogere dichtheid.
Kookpunt van benzyl
Het kookpunt van benzine is 350°C (662°F). Het is de temperatuur waarbij de dampdruk van een vloeistof gelijk is aan de atmosferische druk en de vloeistof in damp verandert. Het kookpunt van een stof hangt af van verschillende factoren, zoals druk, molecuulgewicht en intermoleculaire krachten.
Benzyl-smeltpunt
Het smeltpunt van benzil is 98°C (270°F). Dit is de temperatuur waarbij een vaste stof in een vloeistof verandert. Het smeltpunt van benzil is relatief laag, waardoor het een nuttig tussenproduct is bij organische syntheses.
Benzile molaire massa
De molaire massa van C14H10O2 is 210,24 g/mol. Het is de hoeveelheid stof die hetzelfde aantal entiteiten bevat (bijvoorbeeld atomen, moleculen, ionen) als het aantal entiteiten in 12 gram pure koolstof-12. De molaire massa van benzil wordt berekend op basis van de molecuulformule C14H10O2.
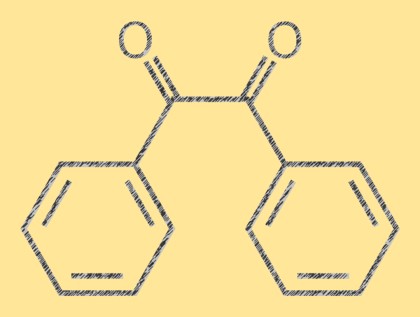
Structuur van benzyl
Benzil is een gele kristallijne organische verbinding met de molecuulformule C14H10O2. Het is een diketon dat bestaat uit twee fenylgroepen die aan een centrale dubbele koolstof-koolstofbinding zijn bevestigd. Het molecuul is vlak en de dubbele binding is vlak. Het benzilmolecuul heeft een karakteristieke felgele kleur, waardoor het bruikbaar is als referentieverbinding in de analytische chemie.
Benzile-formule
De chemische formule voor benzil is C14H10O2. Het vertegenwoordigt de samenstellende elementen van benzil en hun relatieve verhoudingen. Uit de formule blijkt dat benzil bestaat uit 14 koolstofatomen, 12 waterstofatomen en 2 zuurstofatomen.
Benzil NMR
C14H10O2 kan worden geanalyseerd met behulp van kernspinresonantiespectroscopie (NMR). NMR-spectroscopie is een krachtig hulpmiddel dat informatie verschaft over de chemische structuur en interacties van moleculen. Bij NMR-spectroscopie worden de magnetische eigenschappen van de kern gebruikt om de chemische omgeving van de kern te bepalen en om informatie te verkrijgen over de binding en chemische verschuivingen van het molecuul. Het C14H10O2 NMR-spectrum biedt informatie over het aantal protonen in het molecuul en de chemische omgeving van elk proton, waardoor de structuur van C14H10O2 wordt bevestigd.
| Verschijning | Gele kristallijne vaste stof |
| Soortelijk gewicht | 1,20 g/ml |
| Kleur | GEEL |
| Geur | Geurloos |
| Molaire massa | 210,24 g/mol |
| Dikte | 1,20 g/ml |
| Fusie punt | 94,8°C |
| Kookpunt | 350°C (662°F) |
| Flitspunt | Niet beschikbaar |
| oplosbaarheid in water | Enigszins oplosbaar in water |
| Oplosbaarheid | Oplosbaar in ethanol en ether |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Niet beschikbaar |
Veiligheid en gevaren van benzyl
C14H10O2 wordt beschouwd als een matig toxische stof en er moet voorzichtig mee worden omgegaan. Het is licht ontvlambaar en moet uit de buurt van warmtebronnen en vonken worden gehouden. Inademing van C14H10O2-dampen kan oog-, neus- en keelirritatie en ademhalingsproblemen veroorzaken. Huidcontact met C14H10O2 kan huidirritatie en roodheid veroorzaken. Inslikken van C14H10O2 kan maagirritatie en spijsverteringsproblemen veroorzaken. Als het in grote hoeveelheden wordt ingenomen, kan dit tot ernstigere gezondheidsproblemen leiden, zoals braken, duizeligheid en bewustzijnsverlies. Het is belangrijk om beschermende handschoenen en oogbescherming te dragen bij het hanteren van C14H10O2 en om in een goed geventileerde ruimte te werken om blootstelling te minimaliseren. Als er bijwerkingen optreden na contact met C14H10O2, wordt aanbevolen onmiddellijk een arts te raadplegen.
| Gevarensymbolen | Brandbaar |
| Beveiligingsbeschrijving | S24/25 – Vermijd contact met huid en ogen |
| VN-identificatienummers | UN2024 – Gevaarlijke goederen, gevarenklasse 3 |
| HS-code | 2915.90.90 |
| Gevarenklasse | 3 – Ontvlambare vloeistoffen |
| Verpakkingsgroep | III – Matig risico |
| Toxiciteit | Matig giftig |
Benzil-synthesemethoden
C14H10O2 kan op verschillende manieren worden gesynthetiseerd, waaronder de volgende:
- Oxidatie van difenylmethanol: Difenylmethanol wordt geoxideerd met behulp van chroomtrioxide om C14H10O2 te vormen. Dit is een veelgebruikte methode bij de synthese van C14H10O2 omdat deze eenvoudig en kosteneffectief is.
- Wacker-oxidatie: deze methode omvat het gebruik van een palladiumkatalysator en een hydroperoxideoxidatiemiddel om het alkeen om te zetten in C14H10O2. De reactie wordt in het algemeen uitgevoerd in aanwezigheid van een oplosmiddel, zoals ethanol of water.
- Knoevenagel-condensatie: Bij deze methode wordt C14H10O2 gesynthetiseerd door een reactie tussen benzaldehyde en barbituurzuur in aanwezigheid van een sterke base zoals natriumhydroxide of kaliumhydroxide.
- Ullmann-reactie: Deze methode omvat de koppeling van twee aromatische verbindingen via een door koper gekatalyseerde reactie. Bij de synthese van C14H10O2 reageren twee benzaldehydemoleculen om C14H10O2 te vormen.
- Baeyer-Villiger-oxidatie: Bij deze methode wordt C14H10O2 gesynthetiseerd door cyclohexanon te oxideren tot C14H10O2 in aanwezigheid van een peroxyzuuroxidatiemiddel en een katalytische hoeveelheid van een tertiair amine.
De keuze voor de C14H10O2-synthesemethode hangt af van verschillende factoren, waaronder de beschikbaarheid van grondstoffen, de gewenste opbrengst en zuiverheid van het product, en de kosten en tijd die met het syntheseproces gemoeid zijn.
Gebruik van benzyl
C14H10O2 is een veelzijdige chemische stof die vele toepassingen op verschillende gebieden kent. Enkele veel voorkomende toepassingen van C14H10O2 zijn:
- Bij de fijnchemische productie wordt C14H10O2 gebruikt als grondstof bij de productie van diverse fijnchemicaliën, waaronder antioxidanten, vlamvertragers en kleurstoffen.
- Bij de polymeersynthese wordt C14H10O2 gebruikt bij de synthese van polymeren, waaronder polycarbonaten en polyurethaan, met een breed scala aan toepassingen in verschillende industrieën.
- Pesticiden gebruiken C14H10O2 als tussenproduct bij de synthese van bepaalde pesticiden om gewassen en tuinongedierte te bestrijden.
- Cosmetica gebruiken C14H10O2 als geurstof in sommige cosmetische producten, zoals parfums en colognes, om een fris, bloemig aroma te geven.
- De smaak- en geurindustrie gebruikt C14H10O2 als smaak- en geuringrediënt om een houtachtig en bloemig aroma aan voedingsmiddelen en cosmetische producten te geven.
Kortom, C14H10O2 is een veelzijdige chemische stof die een breed scala aan toepassingen kent in verschillende industrieën, waaronder de fijne chemische, farmaceutische en cosmetische industrie.
Vragen:
Is benzil polair?
Ja, C14H10O2 is polair. Het heeft een polaire moleculaire structuur vanwege de aanwezigheid van polaire functionele groepen, zoals carbonyl- (-C=O) en fenyl- (-C6H5) groepen. Deze polaire structuur maakt C14H10O2 oplosbaar in polaire oplosmiddelen, zoals water en alcoholen, maar onoplosbaar in niet-polaire oplosmiddelen, zoals koolwaterstoffen. Door de polaire aard van C14H10O2 kan het ook deelnemen aan verschillende polaire reacties, zoals waterstofbruggen en dipool-dipoolinteracties.
Bij welk type reactie vindt de vorming van benzilzuur plaats?
De vorming van C14H10O2zuur uit C14H10O2 is een soort omleggingsreactie die bekend staat als benzilzuuromlegging. Deze reactie is een herschikking van de carbonylgroep in C14H10O2 om een nieuwe functionele carbonzuurgroep in benzilzuur te vormen. De benzilzuuromlegging is een voorbeeld van een Beckmann-omlegging, een soort nucleofiele substitutiereactie waarbij de omlegging van cyclische ketonen in amiden of carbonzuren betrokken is. Het reactiemechanisme omvat de vorming van een cyclisch tussenproduct, gevolgd door migratie van de carbonylgroep en eliminatie van een vertrekkende groep.
