Benzoylchloride is een chemische verbinding die in verschillende industrieën wordt gebruikt. Het reageert met andere stoffen en vormt derivaten zoals benzoylperoxide, een veelgebruikt ingrediënt bij acnebehandelingen.
| IUPAC-naam | Benzoylchloride |
| Moleculaire formule | C7H5ClO |
| CAS-nummer | 98-88-4 |
| Synoniemen | Benzoëzuur, chloride, benzeencarbonylchloride, fenylcarbonylchloride |
| InChi | InChI=1S/C7H5ClO/c8-6-7(9)4-2-1-3-5-7/h1-5H |
Eigenschappen van benzoylchloride
Benzoylchloride-formule
De formule voor benzoylchloride is C7H5ClO. Het vertegenwoordigt de rangschikking van koolstof-, waterstof-, chloor- en zuurstofatomen in de verbinding. De formule biedt waardevolle informatie over de elementaire samenstelling en structurele samenstelling van benzoylchloride.
Benzoylchloride molaire massa
De molaire massa van benzoylchloride wordt berekend door de atoommassa’s van de samenstellende elementen op te tellen. In dit geval heeft koolstof een molaire massa van 12,01 g/mol, heeft waterstof een molaire massa van 1,01 g/mol, heeft chloor een molaire massa van 35,45 g/mol en heeft zuurstof een molaire massa van 16,00 g/mol. Als we deze waarden bij elkaar optellen, blijkt de molaire massa van benzoylchloride ongeveer 140,57 g/mol te zijn.
Kookpunt van benzoylchloride
Benzoylchloride heeft een kookpunt van ongeveer 197-198°C. Dit is de temperatuur waarbij de vloeibare verbinding onder standaard atmosferische druk overgaat in de gasvormige toestand. Kookpunt geeft inzicht in de vluchtigheid en verdampingseigenschappen van benzoylchloride.
Smeltpunt van benzoylchloride
Het smeltpunt van benzoylchloride is ongeveer -1°C. Dit betekent de temperatuur waarbij de vaste vorm van benzoylchloride overgaat in de vloeibare toestand. Het smeltpunt geeft de fysische eigenschappen van de verbinding aan en het vermogen ervan om van de ene fase naar de andere te gaan.
Dichtheid van benzoylchloride g/ml
Benzoylchloride heeft een dichtheid van ongeveer 1,21 g/ml. Dichtheid verwijst naar de massa van een stof per volume-eenheid. Deze eigenschap geeft informatie over de compactheid of concentratie van benzoylchloride in een bepaald volume.
Benzoylchloride Molecuulgewicht
Het molecuulgewicht van benzoylchloride wordt berekend door de atoomgewichten van alle atomen in een molecuul op te tellen. In dit geval bedraagt het molecuulgewicht van benzoylchloride ongeveer 140,57 g/mol. Het is een essentiële parameter die wordt gebruikt bij stoichiometrische berekeningen en om de hoeveelheid benzoylchloride in chemische reacties te bepalen.
Structuur van benzoylchloride
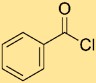
De structuur van benzoylchloride bestaat uit een benzeenring gekoppeld aan een carbonylgroep (-C=O) en een chlooratoom (-Cl) direct gekoppeld aan het koolstofatoom van de carbonylgroep. Deze opstelling kan worden weergegeven door PhCOCl, waarbij “Ph” de benzeenring voorstelt. De structuur benadrukt de connectiviteit en binding van atomen in benzoylchloride.
Oplosbaarheid van benzoylchloride
Benzoylchloride is slecht oplosbaar in water. Het vertoont een hogere oplosbaarheid in organische oplosmiddelen zoals aceton, ether en benzeen. De oplosbaarheidskenmerken van benzoylchloride beïnvloeden de toepassingen en interacties met andere stoffen in verschillende chemische processen.
| Verschijning | Kleurloze tot lichtgele vloeistof |
| Soortelijk gewicht | 1,21 g/ml |
| Kleur | Kleurloos tot lichtgeel |
| Geur | Irriterende en scherpe geur |
| Molaire massa | 140,57 g/mol |
| Dikte | 1,21 g/ml |
| Fusie punt | -1°C |
| Kookpunt | 197-198°C |
| Flitspunt | 77°C |
| oplosbaarheid in water | Reageert |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen zoals aceton, ether en benzeen |
| Dampdruk | 4,95 mmHg bij 25°C |
| Dampdichtheid | 5.3 |
| pKa | 4.18 |
| pH | Niet van toepassing (zuur indien opgelost in water) |
Veiligheid en gevaren van benzoylchloride
Benzoylchloride brengt enkele veiligheidsrisico’s met zich mee en moet met voorzichtigheid worden gehanteerd. Het is zeer irriterend voor de huid, ogen en luchtwegen en veroorzaakt brandwonden en ernstig ongemak bij contact. Inademing van de dampen kan irritatie van de luchtwegen en longschade veroorzaken. Het is essentieel om de juiste beschermende uitrusting te gebruiken, zoals handschoenen, een veiligheidsbril en een gasmasker, wanneer u met benzoylchloride werkt. De verbinding is brandbaar en kan ontbranden bij blootstelling aan hitte of vlammen, waarbij giftige dampen vrijkomen. Bovendien reageert het heftig met water, alcoholen en basen, waardoor brand of explosies kunnen ontstaan. Om de risico’s tot een minimum te beperken, moeten de juiste procedures voor opslag, hantering en verwijdering worden gevolgd.
| Gevarensymbolen | Bijtend, giftig |
| Beveiligingsbeschrijving | Vermijd contact met huid en ogen. Gebruik in een goed geventileerde ruimte. Hanteer met geschikte beschermende uitrusting. |
| VN-identificatienummers | Een 1736 |
| HS-code | 2916.31.00 |
| Gevarenklasse | 8 (bijtend), 6,1 (giftig) |
| Verpakkingsgroep | II (gemiddeld) |
| Toxiciteit | Zeer giftig en bijtend. |
Methoden voor de synthese van benzoylchloride
Er zijn verschillende methoden voor het synthetiseren van benzoylchloride. Een gebruikelijke aanpak is het oxideren van benzaldehyde met behulp van een geschikt oxidatiemiddel, zoals chloorgas of fosforpentachloride (PCl5). Bij deze methode meng je benzaldehyde onder gecontroleerde omstandigheden met het oxidatiemiddel en zo ontstaat benzoylchloride.
Een andere methode omvat de reactie tussen benzoylperoxide en waterstofchloridegas . Benzoylperoxide werkt als radicaalinitiator en bevordert de reactie met waterstofchloride , waarbij benzoylchloride ontstaat.
Om benzoylchloride te bereiden, kan benzoëzuur onder refluxomstandigheden worden behandeld met thionylchloride (SOCl2) of fosfortrichloride (PC13). De reactie produceert een zuurchloride als tussenproduct, dat vervolgens wordt omgezet in benzoylchloride.
Bovendien kan de reactie van benzoyltrichloride met koolmonoxide (CO) in aanwezigheid van een katalysator, zoals koper, ook leiden tot de synthese van benzoylchloride.
Het is belangrijk op te merken dat deze methoden moeten worden uitgevoerd in een goed geventileerde ruimte met de juiste veiligheidsmaatregelen, aangezien benzoylchloride een gevaarlijke verbinding is. Zorgvuldige behandeling en naleving van de juiste laboratoriumprotocollen zijn noodzakelijk om een veilig syntheseproces te garanderen.
Gebruik van benzoylchloride
Benzoylchloride heeft verschillende toepassingen in verschillende industrieën vanwege zijn veelzijdige chemische eigenschappen. Hier zijn enkele opmerkelijke apps:
- Farmaceutische industrie: De farmaceutische industrie gebruikt benzoylchloride als een belangrijk tussenproduct voor het synthetiseren van farmaceutische verbindingen, waaronder analgetica, antiseptica en antihistaminica.
- Polymeerindustrie: In de polymeerindustrie fungeert benzoylchloride als een monomeer en draagt het bij aan de structurele stabiliteit en thermische weerstand van polymeren zoals polycarbonaten, polyamiden en polyesters.
- Organische synthese: Benzoylchloride dient als reagens bij acyleringsreacties, waardoor de introductie van de benzoylgroep in organische moleculen wordt vergemakkelijkt.
- Agrochemicaliën: Benzoylchloride speelt een cruciale rol bij gewasbescherming en ongediertebestrijding door bij te dragen aan de synthese van herbiciden en insecticiden.
- Kleurstofproductie: Benzoylchloride is een voorloper voor de productie van verschillende kleurstoffen en pigmenten, essentieel voor het kleuren van textiel, kunststoffen en drukinkten.
- Parfum- en parfumindustrie: De parfum- en parfumindustrie gebruikt benzoylchloride om parfums en geurstoffen te synthetiseren, waardoor hun aromatische eigenschappen worden verbeterd.
- Chemisch onderzoek: Onderzoekslaboratoria passen benzoylchloride toe bij de synthese van nieuwe chemische verbindingen, wat bijdraagt aan de ontwikkeling van innovatieve materialen en farmaceutische producten.
- Rubberindustrie: De rubberindustrie gebruikt benzoylchloride als verknopingsmiddel om de eigenschappen van rubber te wijzigen, waardoor de duurzaamheid en sterkte ervan wordt verbeterd.
- Productie van lijmen: Fabrikanten gebruiken benzoylchloride om lijmen en afdichtingsmiddelen te produceren, waardoor de hechtingseigenschappen worden verbeterd.
- Textielindustrie: In de textielindustrie fungeert benzoylchloride als katalysator en stabilisator tijdens de productie van synthetische vezels zoals nylon, polyester en elastaan, waardoor de kwaliteit en prestaties ervan worden gegarandeerd.
Deze verschillende toepassingen tonen het belang van benzoylchloride in verschillende industriële sectoren aan.
Vragen:
Vraag: Welke van de volgende reagentia zet benzoylchloride om in fenylpropylketon?
A: Het reagens dat benzoylchloride omzet in fenylpropylketon is een Grignard-reagens van fenylmagnesiumbromide (PhMgBr), gevolgd door een reactie met propylhalogenide.
Vraag: Welk product zou worden gevormd door de reactie van benzoylchloride met 4-chloorfenol?
A: Het product dat wordt gevormd door de reactie van benzoylchloride met 4-chloorfenol is 4-chloorbenzoylfenol.
Vraag: Hoe kan ik de opbrengst van ammonolyse van benzoylchloride vinden?
A: De opbrengst aan ammonolyse van benzoylchloride kan worden bepaald door de verkregen hoeveelheid van het gewenste product te delen door de theoretische opbrengst en te vermenigvuldigen met 100 om dit als een percentage uit te drukken.
Vraag: Is benzoylchloride of benzylchloride meer elektrofiel?
A: Benzoylchloride is elektrofieler dan benzylchloride vanwege de aanwezigheid van de sterk elektronenzuigende carbonylgroep.
Vraag: Welke van de volgende reagentia wordt gebruikt in de volgende reactie? benzoëzuur tot benzoylchloride, hydrolyse van benzoylchloride?
A: Het reagens dat wordt gebruikt bij de omzetting van benzoëzuur in benzoylchloride is thionylchloride (SOCl2), en voor de hydrolyse van benzoylchloride is het water of een waterige base.
Vraag: Welke producten worden gevormd wanneer benzoylchloride reageert met cyclohexanol?
A: De producten die worden gevormd door de reactie van benzoylchloride met cyclohexanol zijn cyclohexylbenzoaat en waterstofchloride (HCl).
Vraag: Hoe droog je benzoylchloride?
A: Benzoylchloride kan worden gedroogd door een geschikt droogmiddel toe te voegen, zoals watervrij calciumchloride of watervrij magnesiumsulfaat, gevolgd door filtratie.
Vraag: Wat is meer elektrofiel: benzoylchloride of benzylchloride?
A: Benzoylchloride is elektrofieler dan benzylchloride vanwege de aanwezigheid van de carbonylgroep, die de elektronendichtheid onderdrukt en de elektrofiliteit verhoogt.
Vraag: Is benzoylchloride oplosbaar in water?
A: Nee, benzoylchloride is niet oplosbaar in water. Het reageert met water en vormt benzoëzuur en zoutzuur.
