Ammoniumsulfaat ((NH4)2SO4) is een veelgebruikte meststof die essentiële voedingsstoffen aan planten levert. Het wordt ook gebruikt in vlamvertragers, bij eiwitzuivering en als voedingsadditief.
| Naam van IUPAC | Ammoniumtetraoxosulfaat (VI) |
| Moleculaire formule | (NH4)2SO4 |
| CAS-nummer | 7783-20-2 |
| Synoniemen | Ammoniumsulfaat, ammoniumsulfaat (2:1), diammoniumsulfaat, diammoniumzout van zwavelzuur, mascagnite, Actamaster, Dolamin |
| InChi | InChI=1S/2H3N.H2O4S/c;;1-5(2,3)4/h2*1H3;(H2,1,2,3,4) |
Eigenschappen van ammoniumsulfaat
Ammoniumsulfaatformule
De formule voor ammoniumsulfaat is (NH4)2SO4. Dit betekent dat één molecuul ammoniumsulfaat twee ammoniumionen (NH4)+ en één sulfaation (SO4)2- bevat. De ammoniumionen en het sulfaation worden bij elkaar gehouden door ionische bindingen.
Ammoniumsulfaat Molaire massa
De molmassa van (NH4)2SO4 bedraagt 132,14 g/mol. Om de molaire massa te berekenen, moeten we de atoommassa’s van alle atomen in de formule bij elkaar optellen. De atoommassa’s zijn:
- Stikstof: 14,01 g/mol
- Waterstof: 1,01 g/mol
- Zwavel: 32,06 g/mol
- Zuurstof: 16,00 g/mol
De molaire massa van (NH4)2SO4 is dus:
(2 x 14,01) + (8 x 1,01) + 32,06 + (4 x 16,00) = 132,14 g/mol
Kookpunt van ammoniumsulfaat
Het kookpunt van (NH4)2SO4 is niet goed gedefinieerd, omdat het ontleedt voordat het het kookpunt bereikt. Bij verhitting boven 235°C begint (NH4)2SO4 water te verliezen en ammoniumbisulfaat (NH4)HSO4 te vormen. Bij verhitting boven 280°C ontleedt ammoniumbisulfaat verder in ammoniak (NH3) en zwavelzuur (H2SO4).
Ammoniumsulfaat Smeltpunt
Het smeltpunt van (NH4)2SO4 is 235°C. Dit is de temperatuur waarbij (NH4)2SO4 overgaat van vast naar vloeibaar. Zoals hierboven vermeld begint (NH4)2SO4 echter ook bij deze temperatuur te ontleden, dus het is geen zuivere vloeibare fase.
Dichtheid van ammoniumsulfaat g/ml
De dichtheid van (NH4)2SO4 is 1,77 g/ml bij kamertemperatuur en druk. Dit betekent dat één milliliter (NH4)2SO4 1,77 gram weegt. De dichtheid van een stof hangt af van de temperatuur en druk ervan, en kan dus onder verschillende omstandigheden enigszins variëren.
Ammoniumsulfaat Molecuulgewicht
Het molecuulgewicht van (NH4)2SO4 is hetzelfde als de molaire massa, namelijk 132,14 g/mol. Het molecuulgewicht is de massa van één mol van een stof, wat gelijk is aan 6,022 x 10^23 moleculen. Het molecuulgewicht kan ook worden uitgedrukt in atomaire massa-eenheden (amu), die gelijk zijn aan 1/12 van de massa van een koolstof-12-atoom. In amu is het molecuulgewicht van (NH4)2SO4 132,14 amu.
Structuur van ammoniumsulfaat
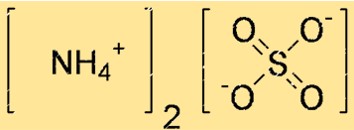
De structuur van (NH4)2SO4 kan worden weergegeven door een Lewis-puntenstructuur of een ball-and-stick-model. Een Lewis-puntstructuur toont de valentie-elektronen van elk atoom en de bindingen daartussen. Een bal-en-stokmodel toont de vorm en grootte van elk atoom en de bindingen daartussen.
In de bovenstaande structuur vertegenwoordigen dubbele lijnen (=) dubbele bindingen, vertegenwoordigen enkele lijnen (-) enkele bindingen en vertegenwoordigen punten (.) alleenstaande elektronenparen.
Oplosbaarheid van ammoniumsulfaat
De oplosbaarheid van (NH4)2SO4 is de hoeveelheid (NH4)2SO4 die bij een bepaalde temperatuur in een bepaalde hoeveelheid water kan oplossen. De oplosbaarheid van (NH4)2SO4 neemt toe bij toenemende temperatuur, zoals blijkt uit de volgende gegevens:
| Temperatuur (°C) | Oplosbaarheid (g/100 ml water) |
| 0 | 70,6 |
| Verschijning | Fijne witte hygroscopische korrels of kristallen |
| Specifieke dichtheid | 1,77 |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 132,14 g/mol |
| Dikte | 1,77 g/cm3 |
| Fusie punt | 235 tot 280°C (ontleedt) |
| Kookpunt | Niet van toepassing (ontbonden) |
| Flitspunt | Niet vlambaar |
| oplosbaarheid in water | 70,6 g per 100 g water (0°C), 74,4 g per 100 g water (20°C), 103,8 g per 100 g water (100°C) |
| Oplosbaarheid | Onoplosbaar in aceton, alcohol en ether |
| Dampdruk | Verwaarloosbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 5,5 (voor ammoniumion) |
| pH | 5 tot 6 (voor een 5% oplossing) |
Veiligheid en gevaren van ammoniumsulfaat
(NH4)2SO4 is niet erg gevaarlijk voor de menselijke gezondheid, maar kan bij contact of inademing irritatie van de huid, ogen, neus en keel veroorzaken. Het kan ook misselijkheid, maagpijn, diarree, braken en slaperigheid veroorzaken als het wordt ingeslikt. Het is schadelijk voor het waterleven en de introductie ervan in het milieu moet worden vermeden. Het ontleedt bij verhitting boven 235°C en vormt giftige gassen zoals ammoniak en zwavelzuur. Het wordt algemeen erkend als veilig als voedingsadditief, maar het kan bij sommige mensen allergische reacties of astmasymptomen veroorzaken.
| Gevarensymbolen | Niet nodig |
| Beveiligingsbeschrijving | Voorkom lozing in het milieu. Inhoud/verpakking afvoeren naar een erkende afvalverwerkingsinstallatie. |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | 31022100 |
| Gevarenklasse | Niet toepasbaar |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | LD50 (oraal, rat) = 2,840 mg/kg |
Methoden voor de synthese van ammoniumsulfaat
(NH4)2SO4 kan op verschillende manieren worden gesynthetiseerd omdat het een anorganisch zout is. Enkele veel voorkomende methoden zijn:
- Neutralisatie van ammoniak en zwavelzuur: Deze methode omvat het mengen van ammoniakgas of een waterige oplossing met zwavelzuur en het verdampen van het water om (NH4)2SO4-kristallen te verkrijgen.
2NH3 + H2SO4 -> (NH4)2SO4
- Ammoniumcarbonaat- en gipsreactie: deze methode omvat het toevoegen van fijnverdeeld gips ( calciumsulfaat ) aan een ammoniumcarbonaatoplossing en het filteren van het calciumcarbonaatneerslag.
(NH4)2CO3 + CaSO4 -> (NH4)2SO4 + CaCO3
- Bijproduct van andere processen: Diverse industriële processen, zoals de zuivering van cokesovengas, de productie van caprolactam, de nikkelraffinage en de ontzwaveling van rookgassen, kunnen (NH4)2SO4 als bijproduct produceren. Bij deze processen wordt gebruik gemaakt van ammoniak of ammoniumverbindingen om zwavel of andere onzuiverheden uit gasstromen te verwijderen, wat resulteert in (NH4)2SO4 als afvalstof of waardevol product.
Gebruik van ammoniumsulfaat
(NH4)2SO4 is een anorganisch zout dat verschillende toepassingen kent, zoals:
- Alkalische bodemmeststof: (NH4)2SO4 verlaagt de pH van de bodem en levert stikstof en zwavel voor de plantengroei. Het is geschikt voor gewassen die zure grond vereisen, zoals bosbessen, aardappelen en tomaten.
- Hulpmiddel voor landbouwspuiten: (NH4)2SO4 verbetert de effectiviteit van in water oplosbare insecticiden, herbiciden en fungiciden door ijzer- en calciumionen te binden die de werking ervan kunnen verstoren. Het verbetert ook de opname van glyfosaat en andere systemische herbiciden door planten.
- Eiwitzuivering: (NH4)2SO4 kan eiwitten uit waterige oplossingen neerslaan door de ionsterkte te vergroten en de oplosbaarheid van eiwitten te verminderen. De uitzoutingsmethode kan worden gebruikt om eiwitten te scheiden op basis van hun grootte, lading en hydrofobiciteit.
- Voedseladditief: Diverse voedingsproducten zoals brood, kaas, wijn en groenten in blik gebruiken (NH4)2SO4 als zuurteregelaar, deegconditioner, gistvoedingsstof en verstevigingsmiddel. De FDA erkent het als over het algemeen veilig.
- Andere toepassingen: (NH4)2SO4 kan worden gebruikt voor het maken van andere ammoniumzouten, brandblussers, vlamvertragers, leerlooierij, textielverven, galvaniseren van metalen en analytische chemie.
Vragen:
Vraag: Wat is de chemische formule van ammoniumsulfaat?
A: De chemische formule voor ammoniumsulfaat is (NH4)2SO4. Dit betekent dat één molecuul ammoniumsulfaat twee ammoniumionen (NH4)+ en één sulfaation (SO4)2- bevat.
Vraag: Is ammoniumsulfaat oplosbaar?
A: (NH4)2SO4 is oplosbaar in water, maar onoplosbaar in aceton, alcohol en ether. Het kan 70,6 gram per 100 gram water bij 0°C, 74,4 gram per 100 gram water bij 20°C en 103,8 gram per 100 gram water bij 100°C oplossen.
Vraag: Hoeveel ammoniumsulfaat per gallon water?
A: De hoeveelheid (NH4)2SO4 per gallon water is afhankelijk van de gewenste concentratie en de temperatuur van het water. Als de gewenste concentratie bijvoorbeeld 10% (w/v) is en de watertemperatuur 20°C is, dan is de hoeveelheid (NH4)2SO4 per gallon water:
10% (w/v) = 10 gram per 100 ml water 1 gallon = 3785,41 ml 10 gram x 3785,41 ml / 100 ml = 378,54 gram De hoeveelheid (NH4)2SO4 per gallon water is dus 378,54 gram.
Vraag: Vindt er een reactie plaats wanneer waterige oplossingen van ammoniumsulfaat en calciumchloride worden gecombineerd?
A: Nee, er vindt geen reactie plaats als waterige oplossingen van (NH4)2SO4 en calciumchloride worden gecombineerd. De twee zouten zijn inderdaad oplosbaar in water en vormen geen onoplosbaar neerslag. De resulterende oplossing bevat vier ionen: ammonium (NH4)+, sulfaat (SO4)2-, calcium (Ca2+) en chloride (Cl)-.
Vraag: Hoe eiwitten neerslaan met ammoniumsulfaat?
A: Om eiwitten te laten neerslaan met (NH4)2SO4 kunnen de volgende stappen worden gevolgd:
- Bereid een waterige oplossing van (NH4)2SO4 met een bekende concentratie en volume.
- Voeg de eiwitoplossing langzaam en al roerend toe aan de (NH4)2SO4-oplossing.
- Controleer de troebelheid of optische dichtheid van het mengsel om de hoeveelheid eiwitprecipitatie te bepalen.
- Centrifugeer het mengsel om de eiwitpellet van het supernatant te scheiden.
- Gooi het supernatant weg en was de eiwitpellet met buffer of water om overtollig zout te verwijderen.
- Resuspendeer of oplosbaar de eiwitpellet in een geschikte buffer voor verdere analyse of gebruik.
Vraag: Hoeveel gram zitten er in 6,90 moleculen ammoniumsulfaat?
A: Om erachter te komen hoeveel gram er in 6,90 moleculen (NH4)2SO4 zit, moeten we het getal van Avogadro en de molaire massa van (NH4)2SO4 gebruiken. Het getal van Avogadro is 6,022 x 10^23, wat betekent dat één mol van welke stof dan ook evenveel moleculen bevat. De molaire massa van (NH4)2SO4 is 132,14 g/mol, wat betekent dat één mol (NH4)2SO4 evenveel gram weegt. Daarom kunnen we deze formule gebruiken om te berekenen hoeveel gram er in 6,90 moleculen (NH4)2SO4 zit:
gram = moleculen x molaire massa / Avogadro-getal gram = 6,90 x 132,14 / 6,022 x 10^23 gram = 1,52 x 10^-21 Er zit dus 1,52 x 10^-21 gram in 6,90 moleculen (NH4)2SO4.
Vraag: Hoeveel zwavel zit er in ammoniumsulfaat?
A: (NH4)2SO4 bevat 24 massaprocent zwavel. Dit kan worden berekend met behulp van de procentuele samenstellingsformule en de molmassa’s van zwavel en (NH4)2SO4. De molaire massa van zwavel is 32,06 g/mol en de molaire massa van (NH4)2SO4 is 132,14 g/mol. Daarom is het percentage zwavel in (NH4)2SO4:
percentage = molaire massa zwavel x 100 / molaire massa ammoniumsulfaat percentage = 32,06 x 100 / 132,14 percentage = 24,26%
Vraag: Welk van deze zouten is een neutraal zout? na2so4 nacn kf (nh4)2so4
A: Een neutraal zout is een zout dat de pH van de oplossing niet beïnvloedt wanneer het in water wordt opgelost. Het wordt gevormd door de reactie van een sterk zuur en een sterke base. Van de vier gegeven zouten is alleen na2so4 een neutraal zout. Het wordt gevormd door de reactie van natriumhydroxide (een sterke base) en zwavelzuur (een sterk zuur). Andere zouten zijn zuur of basisch. Nacn is een basisch zout, gevormd door de reactie van natriumhydroxide (een sterke base) en blauwzuur (een zwak zuur). Kf is een basisch zout, gevormd door de reactie van kaliumhydroxide (een sterke base) en fluorwaterstofzuur (een zwak zuur). (Nh4)2so4 is een zuur zout, gevormd door de reactie van ammoniumhydroxide (een zwakke base) en zwavelzuur (een sterk zuur).
Vraag: Wat is de molaire massa van (nh4)2so4?
A: De molaire massa van (nh4)2so4 is 132,14 g/mol. Om de molaire massa te vinden, moeten we de atoommassa’s van alle atomen in de formule bij elkaar optellen. De atoommassa’s zijn:
- Stikstof: 14,01 g/mol
- Waterstof: 1,01 g/mol
- Zwavel: 32,06 g/mol
- Zuurstof: 16,00 g/mol
De molaire massa van (nh4)2so4 is dus:
(2 x 14,01) + (8 x 1,01) + 32,06 + (4 x 16,00) = 132,14 g/mol
Vraag: Is (nh4)2so4 oplosbaar in water?
A: Ja, (nh4)2so4 is oplosbaar in water. Het kan tot 70,6 gram per 100 gram water oplossen bij 0°C, 74,4 gram per 100 gram water bij 20°C en 103,8 gram per 100 gram water bij 100°C.
