Ammoniumpersulfaat ((NH4)2S2O8) is een wit poeder. Het lost op in water en geeft zuurstof af. Het kan bleken, etsen of polymerisatie initiëren.
| Naam van IUPAC | Ammoniumperoxydisulfaat |
| Moleculaire formule | (NH4)2S2O8 |
| CAS-nummer | 7727-54-0 |
| Synoniemen | Ammoniumpersulfaat, Ammoniumperoxodisulfaat, Diammoniumpersulfaat, Diammoniumperoxydisulfaat |
| InChi | InChI=1S/2H3N.H2O8S2/c;;1-9(2,3)7-8-10(4,5)6/h2*1H3;(H,1,2,3)(H,4,5 ,6) |
Eigenschappen van ammoniumpersulfaat
Ammoniumpersulfaatformule
De formule voor ammoniumpersulfaat is (NH4)2S2O8. Het bestaat uit twee ammoniumkationen (NH4+) en één persulfaatanion (S2O82-). Het persulfaatanion heeft twee sulfaatgroepen (SO42-) verbonden door een peroxidebinding (OO).
Ammoniumpersulfaat Molaire massa
De molmassa van (NH4)2S2O8 bedraagt 228,18 g/mol. Dit wordt berekend door de atoommassa’s van alle atomen in de formule op te tellen: 2 x 14,01 (N) + 8 x 1,01 (H) + 2 x 32,06 (S) + 8 x 16,00 (O).
Kookpunt van ammoniumpersulfaat
(NH4)2S2O8 heeft geen kookpunt omdat het ontleedt voordat het deze temperatuur bereikt. Het ontleedt bij ongeveer 120°C (248°F) in ammoniak, stikstof, zuurstof en water. De ontledingsreactie is:
(NH4)2S2O8 -> 2NH3 + N2 + O2 + 2H2O
Ammoniumpersulfaat Smeltpunt
(NH4)2S2O8 heeft geen smeltpunt omdat het ontleedt voordat het deze temperatuur bereikt. Het ontleedt bij ongeveer 120°C (248°F) in ammoniak, stikstof, zuurstof en water. De ontledingsreactie is:
(NH4)2S2O8 -> 2NH3 + N2 + O2 + 2H2O
Dichtheid van ammoniumpersulfaat g/ml
De dichtheid van (NH4)2S2O8 is 1,98 g/ml bij 25°C. Dit betekent dat één milliliter (NH4)2S2O8 1,98 gram weegt.
Ammoniumpersulfaat Molecuulgewicht
Het molecuulgewicht van (NH4)2S2O8 is hetzelfde als de molaire massa, namelijk 228,18 g/mol. Dit betekent dat één mol (NH4)2S2O8 228,18 gram weegt.
Structuur van ammoniumpersulfaat
De structuur van (NH4)2S2O8 kan worden weergegeven door de volgende Lewis-structuur:
OO
|| ||
O=S||-OOS||=O
|| ||
OO
/\
NH NH
\/
H
/\
NH NH
\/
H
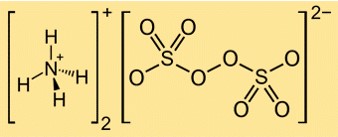
In deze structuur is elk zwavelatoom gebonden aan vier zuurstofatomen in een tetraëdrische geometrie, en heeft elk zuurstofatoom twee paar vrije elektronen. De peroxidebinding tussen de twee sulfaatgroepen is een enkele binding met één paar elektronen. Ammoniumkationen worden gevormd uit stikstofatomen die drie elektronen delen met elk drie waterstofatomen en een positieve lading hebben.
Oplosbaarheid van ammoniumpersulfaat
(NH4)2S2O8 is zeer oplosbaar in water, veel beter dan het bijbehorende kaliumzout 1 . Het lost op in water en vormt ammoniumionen en persulfaationen, die verder kunnen dissociëren in sulfaatradicalen:
(NH4)2S2O8 -> 2NH4+ + S2O82-
S2O82- -> 2 SO4•-
De oplosbaarheid van (NH4)2S2O8 in water neemt toe bij toenemende temperatuur. Bij 25°C kan het tot 80 g/100 ml water oplossen. Het is ook matig oplosbaar in methanol.
| Verschijning | Witte tot geelachtige kristallen |
| Specifieke dichtheid | 1,98 |
| Kleur | Wit tot geelachtig |
| Geur | Zoet en onaangenaam |
| Molaire massa | 228,18 g/mol |
| Dikte | 1,98 g/ml bij 25°C |
| Fusie punt | 120°C (ontleedt) |
| Kookpunt | N.v.t. (ontbonden) |
| Flitspunt | N.v.t |
| oplosbaarheid in water | 80 g/100 ml bij 25°C |
| Oplosbaarheid | Matig oplosbaar in MeOH |
| Dampdruk | N.v.t |
| Dampdichtheid | N.v.t |
| pKa | N.v.t |
| pH | N.v.t |
Veiligheid en gevaren van ammoniumpersulfaat
(NH4)2S2O8 is een sterk oxidatiemiddel dat brand kan intensiveren en explosief kan reageren met brandbare materialen. Het kan ook verschillende gezondheidseffecten veroorzaken als het wordt ingeslikt, ingeademd of in contact komt met de huid of ogen. Het kan de huid, ogen, neus, keel en longen irriteren. Het kan ook allergische reacties veroorzaken, zoals huiduitslag, astma of ademhalingsmoeilijkheden. Het is schadelijk voor het waterleven. Er moet daarom voorzichtig mee worden omgegaan en met de juiste beschermende uitrusting. Het moet uit de buurt van hitte, vonken, vlammen en andere onverenigbare stoffen worden bewaard.
| Gevarensymbolen | O (oxidant), Xn (schadelijk), Xi (irriterend) |
| Beveiligingsbeschrijving | S17 (Verwijderd houden van brandbare materialen), S26 (Bij aanraking met de ogen onmiddellijk met veel water afspoelen en een arts raadplegen), S36/37/39 (Draag geschikte beschermende kleding, handschoenen en oog-/gelaatsbescherming), S45 (In geval van een ongeval of als u zich onwel voelt, zoek dan onmiddellijk medische hulp) |
| VN-identificatienummers | VN 1444 |
| HS-code | 28334000 |
| Gevarenklasse | 5.1 (Oxiderende materialen) |
| Verpakkingsgroep | III |
| Toxiciteit | Orale LD50 rat: 689 mg/kg, LC50 inhalatie rat: 2,95 mg/L/4u, dermale LD50 rat: 2000 mg/kg |
Methoden voor de synthese van ammoniumpersulfaat
Er zijn verschillende methoden mogelijk om (NH4)2S2O8, een anorganisch zout, te bereiden.
Een van de meest gebruikelijke methoden is het elektrolyseren van een koude, geconcentreerde oplossing van ammoniumsulfaat ((NH4)2SO4) en zwavelzuur (H2SO4) .
Deze methode werd voor het eerst beschreven door Hugh Marshall. Bij elektrolyse wordt een elektrische stroom door de oplossing geleid met behulp van een platina-anode en een poreuze zilverkathode.
Aan de anode produceert de elektrolyse van zwavelzuur waterstofsulfaationen HSO4-, die zich met water verbinden om persulfaationen S2O82- en waterstofgas H2 te creëren. Aan de kathode ondergaat zuurstofgas O2 een reductie om waterstofperoxide H2O2 te produceren, dat reageert met ammoniumionen NH4+ om (NH4)2S2O8 (NH4)2S2O8 en water H2O te vormen.
De algemene reactie is als volgt:
(NH4)2SO4 + 2 H2SO4 -> (NH4)2S2O8 + 2 H2O + H2 + O2
Door afkoeling en filtering kan uit de elektrolytoplossing (NH4)2S2O8 worden gekristalliseerd.
Een andere methode om (NH4)2S2O8 te bereiden is de oxidatie van ammoniumbisulfaat NH4HSO4 met ozon O3 of waterstofperoxide H2O2 . Deze methode levert een hogere opbrengst en zuiverheid van (NH4)2S2O8 op dan de elektrolysemethode. De reactie luidt:
NH4HSO4 + O3 -> (NH4)2S2O8 + H2O
Goud
NH4HSO4 + H2O2 -> (NH4)2S2O8 + 2H2O
Gebruik van ammoniumpersulfaat
(NH4)2S2O8 is een veelzijdige chemische stof die vele toepassingen kent in diverse industrieën en toepassingen. Enkele van de meest voorkomende toepassingen zijn:
- Het dient als bleekmiddel en chemische voorloper bij de synthese van andere industrieel belangrijke verbindingen.
- Het initieert het polymerisatieproces en fabrikanten gebruiken het vooral bij de productie van polystyreen.
- PCB-fabrikanten gebruiken het als etsmiddel om koper en andere metalen van het oppervlak te verwijderen.
- De halfgeleiderindustrie gebruikt (NH4)2S2O8 ook als etsmiddel om siliciumwafels schoon te maken en te polijsten.
- Laboratoria gebruiken het als reinigings- en desinfectiemiddel voor apparatuur, glaswerk en watersystemen.
- Het voorkomt het bruin worden van fruit en groenten, waardoor het een additief is dat wordt gebruikt om voedsel te conserveren.
- Bij verschillende chemische reacties wordt het gebruikt als oxidatiemiddel voor de synthese van organische peroxiden, sulfonen en sulfonamiden.
- Batterijen gebruiken het als depolarisator om hun prestaties en levensduur te vergroten.
- Haarbleekmiddelen gebruiken het als een veelgebruikt ingrediënt om de haarkleur lichter te maken door het melaninepigment te oxideren.
Vragen:
Vraag: Hoe lang gaat ammoniumpersulfaat mee?
A: (NH4)2S2O8 is een stabiele verbinding die in vaste toestand voor onbepaalde tijd kan worden opgeslagen zonder ontleding. Het kan echter na verloop van tijd zijn effectiviteit verliezen als het in water wordt opgelost. De houdbaarheid van een 10% oplossing van (NH4)2S2O8 is ongeveer 2 tot 4 weken bij kamertemperatuur en 2 tot 3 maanden bij 4°C 1 2 . De oplossing moet worden beschermd tegen licht en hitte en periodiek worden gecontroleerd op de aanwezigheid van belletjes of neerslag die op ontbinding wijzen.
Vraag: Wat doet ammoniumpersulfaat?
A: (NH4)2S2O8 is een sterk oxidatiemiddel dat zuurstofradicalen kan vrijgeven in een waterige oplossing. Deze radicalen kunnen verschillende chemische reacties veroorzaken of versnellen, zoals polymerisatie, bleken, etsen, reinigen en desinfectie. (NH4)2S2O8 kan ook fungeren als bron van sulfaationen voor de synthese van andere verbindingen.
Vraag: Waar moet je ammoniumpersulfaat in mengen?
A: (NH4)2S2O8 is zeer oplosbaar in water en kan met water worden gemengd om oplossingen met verschillende concentraties te bereiden. De oplosbaarheid van (NH4)2S2O8 in water neemt toe bij toenemende temperatuur. Bij 25°C kan het tot 80 g/100 ml water oplossen. Het is ook matig oplosbaar in methanol. (NH4)2S2O8 mag niet worden gemengd met onverenigbare stoffen, zoals brandbare materialen, reductiemiddelen, metalen, zuren of basen, omdat het daarmee heftig of explosief kan reageren.
Vraag: Is ammoniumperoxydisulfaat hetzelfde als ammoniumpersulfaat?
A: Ja, ammoniumperoxydisulfaat is een andere naam voor (NH4)2S2O8. Het zijn beide synoniemen voor dezelfde verbinding met de formule (NH4)2S2O8.
Vraag: Waar wordt ammoniumpersulfaat voor gebruikt in SDS-PAGE?
A: SDS-PAGE (natriumdodecylsulfaatpolyacrylamidegelelektroforese) is een techniek voor het scheiden van eiwitten op basis van hun grootte en lading. (NH4)2S2O8 wordt gebruikt als katalysator voor de polymerisatie van acrylamide- en bisacrylamidemonomeren om een polyacrylamidegelmatrix te vormen. (NH4)2S2O8 genereert vrije radicalen die de verknopingsreactie tussen de monomeren initiëren.
Vraag: Hoe maak je 10% ammoniumpersulfaat?
A: Om een 10% oplossing van (NH4)2S2O8 te bereiden, weegt u 10 g vast (NH4)2S2O8 af en lost u dit op in 90 ml gedestilleerd water. Roer tot het volledig is opgelost en breng het over in een maatkolf van 100 ml. Vul tot de maatstreep met gedestilleerd water en meng goed. Bewaar de oplossing in een donkere fles bij 4°C of kamertemperatuur.
Vraag: Hoe repareer ik een door een boog geactiveerd ammoniumpersulfaat?
A: Een boogflits is een defect dat wordt veroorzaakt door een elektrische boog die het oppervlak van een metaal beschadigt. Dit kan de sterkte en corrosieweerstand van het metaal verminderen en tot barsten of falen leiden. Om een vlamboog te repareren, is één methode het gebruik van (NH4)2S2O8 als etsmiddel om het aangetaste gebied te verwijderen. De procedure is als volgt:
- Reinig het metalen oppervlak met aceton of alcohol om vuil en vet te verwijderen.
- Breng met een borstel of wattenstaafje een dunne laag ammoniumpersulfaatoplossing (10-20%) aan op het gebied waar de boog ontsteekt.
- Wacht 5 tot 10 minuten totdat er belletjes op het oppervlak verschijnen, wat aangeeft dat er een oxidatiereactie plaatsvindt.
- Spoel het oppervlak af met water en droog het af met een schone doek.
- Herhaal het proces totdat de boogvorming volledig is verwijderd.
- Inspecteer het oppervlak op scheuren of putten en vul deze indien nodig met geschikt vulmateriaal.
- Breng een beschermende coating of verf aan om verdere corrosie te voorkomen.
Vraag: Is ammoniumpersulfaat een oppervlakteactieve stof?
A: Nee, (NH4)2S2O8 is geen oppervlakteactieve stof. Een oppervlakteactieve stof is een stof die de oppervlaktespanning van een vloeistof of tussen twee vloeistoffen verlaagt en micellen of emulsies kan vormen. (NH4)2S2O8 heeft deze eigenschappen niet. Het is een oxidatiemiddel dat zuurstofradicalen in een waterige oplossing kan vrijgeven.
Vraag: Welke aspecten van uw experiment worden gecontroleerd door TEMED en ammoniumpersulfaat?
A: TEMED en (NH4)2S2O8 worden gebruikt om de polymerisatie van acrylamide- en bisacrylamidemonomeren te controleren om een polyacrylamidegelmatrix voor elektroforese te vormen. TEMED en (NH4)2S2O8 fungeren als vrije radicalen genererende katalysatoren die de verknopingsreactie tussen monomeren initiëren en versnellen. De concentratie en verhouding van TEMED en (NH4)2S2O8 beïnvloeden de snelheid en volledigheid van de polymerisatie, evenals de poriegrootte en mechanische sterkte van de gel.
Vraag: Reageert ammoniumpersulfaat met lucht?
A: Ja, (NH4)2S2O8 kan reageren met lucht, vooral in vochtige omstandigheden. (NH4)2S2O8 kan vocht uit de lucht opnemen en hydrolyse ondergaan, waarbij ammoniumsulfaat en waterstofperoxide ontstaan. Waterstofperoxide kan verder worden afgebroken tot water en zuurstofgas, waardoor warmte en druk vrijkomen. Dit kan ertoe leiden dat de (NH4)2S2O8-container scheurt of explodeert als deze niet goed wordt geventileerd. (NH4)2S2O8 kan ook reageren met zuurstof in de lucht en zo ozon vormen, een giftig gas. Daarom moet (NH4)2S2O8 worden opgeslagen in een koele, droge, goed geventileerde ruimte, uit de buurt van hitte, vonken, vlammen en andere onverenigbare stoffen.
