Ammoniumoxide ((NH4)2O) is een witte kristallijne verbinding die oplosbaar is in water en fungeert als een zwakke base. Het ontstaat door de reactie van ammoniak en zuurstof en wordt gebruikt in meststoffen, schoonmaakmiddelen en als brandblusser.
| IUPAC-naam | Ammoniumoxide |
| Moleculaire formule | (NH4)2O |
| CAS-nummer | 12046-03-6 |
| Synoniemen | Ammoniumhydroxide, ammoniakoplossing, Aqua Ammonia |
| InChi | InChI=1S/H4N.O/h1H4;/q+1;-1 |
Eigenschappen van ammoniumoxide
Ammoniumoxide-formule
De formule voor ammoniumoxide is (NH4)2O. Het is een verbinding bestaande uit één stikstofatoom en vier waterstofatomen gecombineerd met één zuurstofatoom.
Molaire massa van ammoniumoxide
De molaire massa van ammoniumoxide is ongeveer 52,07 gram per mol. Het wordt berekend door de atoomgewichten van alle atomen in het molecuul op te tellen. Molaire massa helpt bij het bepalen van het aantal deeltjes dat aanwezig is in een bepaalde hoeveelheid van een stof.
Kookpunt van ammoniumoxide
Het kookpunt van (NH4)2O ligt rond de 90°C. Het is de temperatuur waarbij de dampdruk van een vloeistof gelijk is aan de druk eromheen, waardoor de vloeistof in een gas verandert. Het kookpunt van een stof is een belangrijke fysische eigenschap die kan worden gebruikt om verschillende verbindingen te identificeren en te onderscheiden.
Smeltpunt van ammoniumoxide
Het smeltpunt van (NH4)2O ligt ongeveer -6°C. Dit is de temperatuur waarbij een vaste stof in een vloeistof verandert. Het smeltpunt van een stof kan worden gebruikt om verschillende verbindingen te identificeren en te onderscheiden, maar ook om de zuiverheid van een stof te bepalen.
Dichtheid van ammoniumoxide g/ml
De dichtheid van (NH4)2O is ongeveer 1,02 g/ml. Dichtheid is de hoeveelheid massa per volume-eenheid en is een fundamentele fysieke eigenschap van een stof. De dichtheid van een stof kan worden gebruikt om verschillende verbindingen te identificeren en te onderscheiden, maar ook om de zuiverheid van een stof te bepalen.
Molecuulgewicht van ammoniumoxide
Het molecuulgewicht van ammoniumoxide is ongeveer 52,07 g/mol. Het is de som van de atoomgewichten van alle atomen die in een molecuul van de stof aanwezig zijn. Het molecuulgewicht kan worden gebruikt om het aantal mol van een stof in een bepaalde massa te berekenen en is een belangrijke fysische eigenschap die in veel wetenschapsgebieden wordt gebruikt.
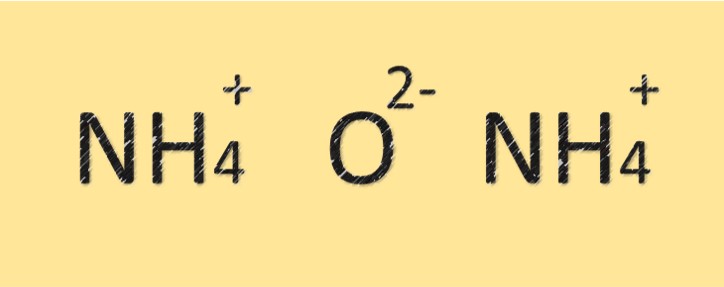
Structuur van ammoniumoxide
Ammoniumoxide is een verbinding die bestaat uit stikstof- en zuurstofatomen. Het heeft de molecuulformule (NH4)2O en is samengesteld uit twee stikstofatomen en één zuurstofatoom. Het stikstofatoom is via een covalente binding met het zuurstofatoom verbonden en heeft ook een positieve lading. De verbinding heeft een basisch of alkalisch karakter vanwege de aanwezigheid van het ammoniumion.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 1,02 g/cm³ |
| Kleur | Wit |
| Geur | Ammoniak |
| Molaire massa | 52,07 g/mol |
| Dikte | 1,02 g/cm³ |
| Fusie punt | -6°C |
| Kookpunt | 90°C |
| Flitspunt | N.v.t |
| oplosbaarheid in water | Oplosbaar |
| Oplosbaarheid | Oplosbaar in water |
| Dampdruk | N.v.t |
| Dampdichtheid | N.v.t |
| pKa | N.v.t |
| pH | 11,6 (100 g/l, H2O, 20°C) |
Veiligheid en gevaren van ammoniumoxide
(NH4)2O is irriterend voor de ogen, de huid en de luchtwegen. Inademing van de dampen kan hoesten, kortademigheid en longirritatie veroorzaken. Contact met de huid kan jeuk en roodheid veroorzaken. De verbinding moet met voorzichtigheid worden gehanteerd en er moeten beschermende maatregelen zoals handschoenen en oogbescherming worden gebruikt. Bij blootstelling moeten de getroffen gebieden met water worden afgespoeld en moet medische hulp worden ingeroepen als de symptomen aanhouden. Het is ook brandbaar en moet uit de buurt van ontstekingsbronnen worden gehouden.
| Gevarensymbolen | Irriterend |
| Beveiligingsbeschrijving | S26-S36/37/39 |
| VN-identificatienummers | VN2672 |
| HS-code | 2841.90.90 |
| Gevarenklasse | 8 |
| Verpakkingsgroep | III |
| Toxiciteit | Irriterend voor de ogen, de huid en de luchtwegen |
Methoden voor de synthese van ammoniumoxide
(NH4)2O kan op verschillende manieren worden gesynthetiseerd, waaronder de thermische ontleding van ammoniumnitraat en de reactie tussen ammoniakgas en zuurstofgas.
Eén methode omvat de thermische ontleding van ammoniumnitraat, een veel voorkomende meststof. Bij de reactie ontstaan ammoniak en stikstofdioxide, die vervolgens worden geoxideerd tot stikstofdioxide en stikstofmonoxide. Stikstofmonoxide reageert met meer ammoniakgas en vormt (NH4)2O.
Een andere methode is het leiden van ammoniakgas over een verwarmde katalysator, waardoor de stikstof- en zuurstofatomen zich verenigen en (NH4)2O vormen. Beide methoden produceren (NH4)2O als een witte kristallijne vaste stof, die kan worden gezuiverd door herkristallisatie.
Gebruik van ammoniumoxide
Industrieën gebruiken (NH4)2O voor verschillende doeleinden vanwege het hoge ammoniumgehalte en de sterke alkalische eigenschappen. Als meststof vormt het een stikstofbron voor planten. Reinigingsmiddelen gebruiken het om vet en vuil op te lossen. De metallurgische industrie gebruikt het als reductiemiddel voor metaaloxiden, vooral bij de productie van aluminium. Als koelmiddel wordt het gebruikt in industriële koelsystemen en als stikstofbron bij de productie van salpeterzuur. In het laboratorium gebruiken scheikundigen het als bron van ammoniak voor chemische reacties. De veelzijdigheid van (NH4)2O maakt het een waardevolle chemische stof met meerdere toepassingen in alle sectoren.
