Ammoniumnitraat (NH4NO3) is een chemische verbinding. Het kan worden gebruikt als meststof of als explosief. Het is zeer oplosbaar in water en hygroscopisch.
| Naam van IUPAC | Ammonium nitraat |
| Moleculaire formule | NH4NO3 |
| CAS-nummer | 6484-52-2 |
| Synoniemen | Ammoniumzout van salpeterzuur, Ammoniumnitraat (AN), Ammoniumnitratum, Nitraam, Nitramon |
| InChi | InChI=1S/NO3.H3N/c2-1(3)4;/h;1H3/q-1;/p+1 |
Eigenschappen van ammoniumnitraat
Ammoniumnitraatformule
Ammoniumnitraat is een chemische verbinding met de formule NH4NO3. Het bestaat uit twee ionen: ammonium (NH4+) en nitraat (NO3-), die bij elkaar worden gehouden door een ionische binding 2 . Het is een wit kristallijn poeder dat gemakkelijk oplosbaar is in water.
Ammoniumnitraat Molaire massa
De molmassa van NH4NO3 bedraagt 80,043 g/mol. Het kan worden berekend door de molaire massa van de samenstellende elementen op te tellen: stikstof, waterstof en zuurstof. De molaire massa van stikstof is 14,0067 g/mol, de molaire massa van waterstof is 1,00784 g/mol en de molaire massa van zuurstof is 15,9999 g/mol.
De molaire massa van NH4NO3 = 2 x molaire massa stikstof + 4 x molaire massa waterstof + 3 x molaire massa zuurstof
De molmassa van NH4NO3 = 28,0134 g/mol + 4,03136 g/mol + 47,9997 g/mol
De molmassa van NH4NO3 = 80,043 g/mol
Kookpunt van ammoniumnitraat
NH4NO3 heeft geen gedefinieerd kookpunt. Het ontleedt bij hoge temperaturen, waarbij gassen zoals stikstof, zuurstof en waterdamp vrijkomen. De ontledingstemperatuur van NH4NO3 varieert afhankelijk van de zuiverheid, vochtigheid en de aanwezigheid van onzuiverheden of additieven. De ontledingstemperatuur van zuiver NH4NO3 bedraagt ongeveer 210°C of 483 K.
Smeltpunt van ammoniumnitraat
Het smeltpunt van NH4NO3 is 169,6 °C of 442,8 K. Bij deze temperatuur ondergaat het een faseovergang van een rhomboëdrische kristalstructuur naar een kubische kristalstructuur. Het kan ook een eutectisch mengsel vormen met water, dat een lager smeltpunt heeft van ongeveer -16 ° C of 257 K.
Dichtheid van ammoniumnitraat g/ml
De dichtheid van NH4NO3 is 1,725 g/ml of 1725 kg/m3 bij omgevingstemperatuur en -druk. Het is dichter dan water, dat onder dezelfde omstandigheden een dichtheid heeft van ongeveer 1 g/ml of 1000 kg/m3. De dichtheid van NH4NO3 neemt af naarmate de temperatuur stijgt, als gevolg van thermische uitzetting.
Ammoniumnitraat Molecuulgewicht
Het molecuulgewicht van NH4NO3 is hetzelfde als de molaire massa, namelijk 80,043 g/mol. Het molecuulgewicht is de massa van één mol of 6,022 x 10^(23) moleculen NH4NO3. Het molecuulgewicht kan ook worden uitgedrukt in atomaire massa-eenheden (amu), gedefinieerd als een twaalfde van de massa van een koolstof-12-atoom.
Het molecuulgewicht van NH4NO3 in amu is 80,043 x (1/12) x (10^(23)) amu
Het molecuulgewicht van NH4NO3 in amu is ongeveer 6,669 x 10^(23) amu
Structuur van ammoniumnitraat
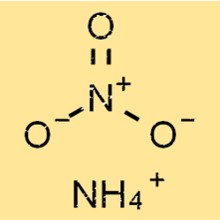
NH4NO3 heeft een eenvoudige ionische structuur, samengesteld uit positief geladen ammoniumionen en negatief geladen nitraationen. Het ammoniumion heeft een tetraëdrische vorm, waarbij vier waterstofatomen door covalente bindingen aan een centraal stikstofatoom zijn gekoppeld.
NH4+
H
|
HNH
|
H
Het nitraation heeft een trigonale vlakke vorm, met drie zuurstofatomen verbonden met een centraal stikstofatoom door covalente bindingen, waarvan er één een dubbele binding is.
Nummer 3-
Oh
||
Oh
Oplosbaarheid van ammoniumnitraat
De oplosbaarheid van NH4NO3 verwijst naar de hoeveelheid van deze verbinding die oplost in water of andere oplosmiddelen. NH4NO3 is zeer oplosbaar in water en de oplosbaarheid ervan neemt toe met de temperatuur. Bij 20°C kan bijvoorbeeld 150 g NH4NO3 oplossen in 100 ml water, maar bij 100°C kan 1024 g oplossen in dezelfde hoeveelheid water. NH4NO3 lost ook op in methanol, ethanol en aceton, maar niet in diethylether of chloroform. De oplosbaarheid van NH4NO3 is afhankelijk van de aanwezigheid van andere stoffen, zoals zuren, basen, zouten of organische verbindingen. Sommige van deze stoffen kunnen de stabiliteit van NH4NO3 beïnvloeden en ervoor zorgen dat het ontbindt of explodeert.
| Verschijning | Witte kristallijne vaste stof |
| Specifieke dichtheid | 1.725 |
| Kleur | Wit of grijs |
| Geur | Geurloos |
| Molaire massa | 80,043 g/mol |
| Dikte | 1,725 g/ml of 1725 kg/m3 |
| Fusie punt | 169,6°C of 442,8K |
| Kookpunt | Ongeveer. 210°C of 483 K (ontleedt) |
| Flitspunt | Niet vlambaar |
| oplosbaarheid in water | Endotherm, 118g/100ml (0°C), 150g/100ml (20°C), 297g/100ml (40°C), 410g/100ml (60°C), 576g/100ml (80°C), 1024g /100ml (100°C) |
| Oplosbaarheid | Oplosbaar in water, methanol, ethanol, aceton; onoplosbaar in diethylether, chloroform |
| Dampdruk | Verwaarloosbaar bij kamertemperatuur |
| Dampdichtheid | Niet van toepassing (vast) |
| pKa | 9,25 (voor NH4+) |
| pH | 5,0-6,0 (10% waterige oplossing) |
Veiligheid en gevaren van ammoniumnitraat
De veiligheid en gevaren van NH4NO3 zijn belangrijk om te weten voor iedereen die deze chemische verbinding hanteert of opslaat. NH4NO3 is een oxidatiemiddel dat brand kan intensiveren en explosies kan veroorzaken als het wordt gemengd met brandbare materialen of wordt blootgesteld aan hitte, schokken of besmetting. Bij de afbraak van NH4NO3 kunnen ook giftige gassen vrijkomen, zoals stikstofoxiden en ammoniak. Daarom moeten mensen deze veiligheidsmaatregelen volgen bij het omgaan met NH4NO3:
- Bewaar het op een koele, droge, goed geventileerde plaats, uit de buurt van brandbronnen, organische stoffen, zuren, metalen en andere onverenigbare materialen.
- Draag beschermende kleding, handschoenen en oog- en gezichtsbescherming tijdens het hanteren.
- Vermijd het ontstaan van stof en zorg voor voldoende ventilatie tijdens het overbrengen.
- Was uw handen en gezicht grondig na gebruik.
- Slik of inhaleer het niet en raadpleeg een arts in geval van blootstelling.
- Informeer lokale hulpverleners over de aanwezigheid van NH4NO3 in de inrichting en stel een noodplan op.
| Gevarensymbolen | O (oxidatiemiddel), Xi (irriterend) |
| Beveiligingsbeschrijving | S17 (verwijderd houden van brandbare materialen), S26 (bij contact met de ogen onmiddellijk met veel water afspoelen en medisch advies inwinnen), S36/37/39 (draag geschikte beschermende kleding, handschoenen en oog-/gelaatsbescherming), S42 (draag tijdens begassing/spuiten geschikte ademhalingsapparatuur) |
| VN-identificatienummers | S17 (verwijderd houden van brandbare materialen), S26 (bij contact met de ogen onmiddellijk met veel water afspoelen en medisch advies inwinnen), S36/37/39 (draag geschikte beschermende kleding, handschoenen en oog-/gelaatsbescherming), S42 (draag tijdens begassing/spuiten geschikte ademhalingsapparatuur) |
| HS-code | 3102.30 (ammoniumnitraat, ook indien in waterige oplossing) |
| Gevarenklasse | 5.1 (oxidatiemiddel) |
| Verpakkingsgroep | III (laag gevaar) |
| Toxiciteit | LD50 (oraal, rat) = 2.085-5.300 mg/kg |
Synthesemethoden voor ammoniumnitraat
Om deze chemische verbinding te produceren, die veel wordt gebruikt als meststof en als explosief, gebruiken scheikundigen verschillende methoden om NH4NO3 te synthetiseren. Er zijn verschillende methoden om NH4NO3 te synthetiseren, maar de meest voorkomende zijn:
- Het Haber-Bosch en Ostwald-proces: deze methode omvat het laten reageren van stikstof- en waterstofgassen om ammoniak te vormen, en vervolgens de ammoniak met lucht te oxideren om salpeterzuur te vormen. Om NH4NO3 te vormen, neutraliseren ze ammoniak en salpeterzuur. Deze methode vereist hoge temperaturen, druk en energie en stoot veel koolstofdioxide uit.
- De metathesereactie: Deze methode omvat het laten reageren van een oplosbaar ammoniumzout met een oplosbaar nitraatzout om NH4NO3 en een ander zout te vormen. Ammoniumsulfaat en bariumnitraat kunnen bijvoorbeeld reageren en NH4NO3 en bariumsulfaat vormen. Deze methode is eenvoudig en vereist geen hoge temperatuur of druk, maar levert wel een bijproduct op dat mogelijk moet worden gescheiden of weggegooid.
- Het plasmaproces: Deze methode bestaat uit het gebruik van een plasma bij lage temperatuur en lage druk om stikstof uit de lucht in de bodem te fixeren, waardoor NH4NO3 direct in de bodem wordt gevormd. Deze methode vereist geen waterstofgas of katalysatoren en stoot geen kooldioxide uit. Het kan ook de bodem verrijken met stikstof en de plantengroei verbeteren.
Gebruik van ammoniumnitraat
Hier zijn enkele toepassingen van NH4NO3:
- Meststof: NH4NO3 is een veel voorkomende stikstofbron voor planten, omdat het ongeveer 33,5% stikstof bevat, wat allemaal beschikbaar is voor opname door planten. Fabrikanten bedekken witte of grijze ammoniumcarbonaatpellets met klei om te voorkomen dat ze aankoeken en vocht opnemen. Ze kunnen het in vaste vorm of in oplossing aanbrengen omdat water het gemakkelijk oplost.
- Explosief: NH4NO3 is een oxidatiemiddel dat de ontploffing van andere explosieven, zoals nitroglycerine, TNT, RDX of aluminiumpoeder, kan versterken. Een veelgebruikt industrieel explosief, dat 80% van de explosieven in Noord-Amerika uitmaakt, bevat ANFO (NH4NO3 en stookolie) als hoofdbestanddeel. Er is een krachtige initiator nodig om het tot ontploffing te brengen wanneer het wordt gebruikt in geïmproviseerde explosieven, maar industriële toepassingen kunnen het ook gebruiken.
- Pyrotechniek: Vuurwerk kan NH4NO3 gebruiken om verschillende effecten te creëren, zoals rook, vonken, sterren en bliksem. Koude kompressen kunnen het ook gebruiken, wat een endotherme reactie veroorzaakt wanneer het met water wordt gemengd.
- Andere toepassingen: Gebruikt als voorloper van lachgas, verdovingsmiddel en drijfgas. Stikstofoxiden kunnen worden gebruikt als absorbeermiddelen, gist en antibiotica kunnen worden gebruikt als voedingsstoffen en diepvriesmengsels kunnen als componenten worden gebruikt.
Vragen:
Vraag: Waar komt ammoniumnitraatmeststof vandaan?
A: NH4NO3-meststof is een synthetisch product dat ontstaat uit de reactie van ammoniak en salpeterzuur. Ammoniak wordt verkregen uit aardgas of andere bronnen, en salpeterzuur wordt geproduceerd door ammoniak met lucht te oxideren. NH4NO3-meststof kan ook worden geproduceerd met behulp van een plasmaproces, waarbij stikstof uit de lucht in de bodem wordt vastgelegd.
Vraag: Wat is ammoniumnitraat?
A: NH4NO3 is een chemische verbinding met de formule NH4NO3. Het is een wit kristallijn zout bestaande uit ammonium- en nitraationen. Het is zeer oplosbaar in water en hygroscopisch in vaste vorm, hoewel het geen hydraten vormt.
Vraag: Waar wordt ammoniumnitraat voor gebruikt?
A: NH4NO3 wordt voornamelijk voor twee doeleinden gebruikt: als meststof en als explosief. Als meststof voorziet het planten van stikstof, essentieel voor hun groei en stofwisseling. Als explosief werkt het als een oxidatiemiddel dat de ontploffing van andere explosieven bevordert, zoals ANFO (NH4NO3 en stookolie) 1 . Het kan ook voor andere doeleinden worden gebruikt, zoals het maken van lachgas (lachgas), koude kompressen, vuurwerk en gistvoedingsstoffen.
Vraag: Wat is de molecuulformule van ammoniumnitraat?
A: De molecuulformule van ammoniumnitraat is NH4NO3. Het heeft een molmassa van 80.043 g/mol en bevat 35 massaprocent stikstof.
Vraag: Waar is ammoniumnitraatmeststof van gemaakt?
A: NH4NO3-meststof is samengesteld uit NH4NO3 en soms andere additieven, zoals klei, antiklontermiddelen of stabilisatoren. Commerciële kwaliteit bevat ongeveer 33,5% stikstof, allemaal in vormen die beschikbaar zijn voor opname door planten.
Vraag: Is ammoniumnitraat een zuur of een base?
A: NH4NO3 is noch een zuur, noch een base, maar een zout. Het kan in water dissociëren in ammonium- en nitraationen, die kunnen werken als zwakke zuren of basen, afhankelijk van de pH van de oplossing. Het ammoniumion heeft een pKa van 9,25, wat betekent dat het een proton kan doneren en als zuur kan fungeren in basische oplossingen. Het nitraation heeft geen pKa, wat betekent dat het geen protonen kan doneren of accepteren, maar het kan als een base fungeren en salpeterzuur vormen met hydroniumionen in zure oplossingen.
Vraag: Explosie van ammoniumnitraat?
A: Een NH4NO3-explosie is een gewelddadige chemische reactie die optreedt wanneer NH4NO3 snel ontleedt en grote hoeveelheden gassen vrijkomen, zoals stikstof, zuurstof en waterdamp. Ontleding kan worden veroorzaakt door hitte, schokken, wrijving, verontreiniging of opsluiting. Een NH4NO3-explosie kan ernstige schade veroorzaken aan gebouwen, mensen en het milieu. Enkele voorbeelden van NH4NO3-explosies zijn de ramp in Texas City in 1947, de Oppau-explosie uit 1921, de Tianjin-explosie in 2015 en de explosie in Beiroet in 2020.
Vraag: Hoe ammoniumnitraat kopen?
A: Voor de aanschaf van NH4NO3 is mogelijk een licentie of vergunning vereist, afhankelijk van het land of de regio waarin u woont. NH4NO3 kan inderdaad worden gebruikt om explosieven of geïmproviseerde explosieven te maken die een bedreiging kunnen vormen voor de openbare veiligheid. Mogelijk moet u bij de aankoop van NH4NO3 ook uw identiteit, adres, contactgegevens en het beoogde gebruik van het product opgeven. NH4NO3 kan worden gekocht bij goedgekeurde leveranciers of distributeurs die voldoen aan de lokale regelgeving en normen. U moet ook de juiste richtlijnen voor opslag en hantering volgen om ongelukken of misbruik van NH4NO3 te voorkomen.
