Wat is ammoniumNH4+?
Het ammoniumion (NH4+) is een positief geladen polyatomisch ion dat bestaat uit één stikstofatoom en vier waterstofatomen. Het wordt vaak aangetroffen in meststoffen en organische verbindingen.
| IUPAC-naam | Azanium |
| Moleculaire formule | NH4+ |
| CAS-nummer | 14798-03-9 |
| Synoniemen | Ammoniumkation, tetrahydridostikstof (1+), aminonium, azanium, stikstofhydridekation, waterstofstikstof, stikstofion |
| InChi | InChI=1S/H3N/h1H3/p+1 |
Opmerking: InChI betreft het ammoniumion in zijn eenvoudigste vorm, met een enkele geïoniseerde waterstof. De werkelijke InChI kan variëren afhankelijk van de chemische omgeving van het ammoniumion.
Ammoniumformule
De formule voor het ammoniumion is NH4+. Het is een polyatomisch kation bestaande uit één stikstofatoom en vier waterstofatomen. Het ammoniumion wordt gevormd door de protonering van ammoniak (NH3) met een waterstofion (H+). Het ammoniumion is een veel voorkomend kation in anorganische en organische verbindingen, waaronder meststoffen, farmaceutische producten en explosieven.
Ammoniumkation
Het ammoniumkation, ook bekend als NH4+, is een positief geladen polyatomair ion dat bestaat uit één stikstofatoom en vier waterstofatomen. Het wordt gevormd wanneer ammoniak (NH3) een proton (H+) uit een zuur accepteert, wat resulteert in de vorming van ammoniumzout.
Molaire massa van ammoniumionen
De molaire massa van het ammoniumion (NH4+) is 18,04 g/mol. Deze waarde wordt berekend door de atoommassa’s van één stikstofatoom (14,01 g/mol) en vier waterstofatomen (elk 1,01 g/mol) op te tellen. Molaire massa is een belangrijke eigenschap van het ammoniumion omdat het de omzetting van zijn massa in mollen mogelijk maakt en omgekeerd. Dit is handig bij veel chemische berekeningen, zoals het bepalen van de hoeveelheid reactanten die nodig zijn voor een chemische reactie.
Kookpunt van ammoniumionen
Omdat het ammoniumion meestal in een zout wordt aangetroffen, zoals ammoniumchloride (NH4Cl), heeft het op zichzelf geen kookpunt. In plaats daarvan wordt het kookpunt van ammoniumchloride, dat 520 ° C bedraagt, beïnvloed door verschillende factoren, zoals de sterkte van de ionische binding tussen het ammoniumion en het chloride-ion, evenals de grootte en vorm van het ammoniumion.
Smeltpunt van ammoniumionen
Net als het kookpunt heeft het ammoniumion geen smeltpunt omdat het geen stof is die in zuivere vorm bestaat. Zouten die het ammoniumion bevatten, zoals ammoniumnitraat (NH4NO3), hebben echter een smeltpunt van 169,6°C. Het smeltpunt van ammoniumnitraat wordt beïnvloed door de sterkte van de ionische binding tussen het ammoniumion en het nitraation, evenals door de kristalstructuur van de verbinding.
Dichtheid van ammoniumionen g/ml
De dichtheid van het ammoniumion (NH4+) is niet van toepassing omdat het een polyatomair ion is en niet als afzonderlijke entiteit bestaat. Zouten die het ammoniumion bevatten, zoals ammoniumsulfaat (NH4)2SO4, hebben echter een dichtheid van 1,77 g/cm³ bij kamertemperatuur. De dichtheid van zouten die het ammoniumion bevatten, wordt beïnvloed door verschillende factoren, waaronder de grootte en vorm van de ionen, de sterkte van de ionische binding en de kristalstructuur van de verbinding.
Molecuulgewicht van ammoniumionen
Het molecuulgewicht van het ammoniumion (NH4+) is 18,04 g/mol, berekend door de atoommassa van één stikstofatoom en vier waterstofatomen bij elkaar op te tellen. Het molecuulgewicht is een belangrijke eigenschap van het ammoniumion omdat het de omzetting van zijn massa in mollen mogelijk maakt en omgekeerd. Dit is handig bij veel chemische berekeningen, zoals het bepalen van de hoeveelheid reactanten die nodig zijn voor een chemische reactie.
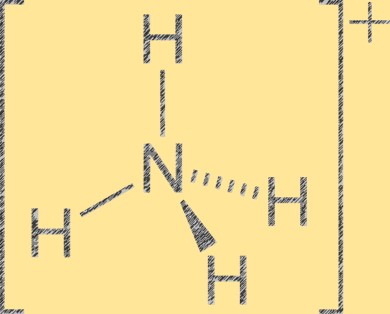
Structuur van ammoniumionen
Het ammoniumion (NH4+) heeft een tetraëdrische moleculaire geometrie met één stikstofatoom in het midden en vier waterstofatomen op de hoeken van de tetraëder. Het stikstofatoom heeft een positieve formele lading van +1, terwijl elk waterstofatoom een formele lading van -1 heeft. Het ammoniumion is een polyatomisch kation dat wordt gevormd door de protonering van ammoniak (NH3) met een waterstofion (H+). Het ammoniumion is een veel voorkomend kation in anorganische en organische verbindingen, waaronder meststoffen, farmaceutische producten en explosieven.
| Verschijning | Wit of kleurloos kristallijn vast gas |
| Soortelijk gewicht | Niet van toepassing (polyatomair ion) |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 18,04 g/mol |
| Dikte | Niet van toepassing (polyatomair ion), zoutdichtheid varieert (bijv. 1,77 g/cm³ voor ammoniumsulfaat) |
| Fusie punt | Niet van toepassing (polyatomair ion), smeltpunt van zouten varieert (bijv. 169,6°C voor ammoniumnitraat) |
| Kookpunt | Niet van toepassing (polyatomair ion), kookpunt van zouten varieert (bijv. 520 °C voor ammoniumchloride) |
| Flitspunt | Niet van toepassing (polyatomair ion) |
| oplosbaarheid in water | Zeer oplosbaar (volledig mengbaar) in water |
| Oplosbaarheid | Oplosbaar in alcoholen en vloeibare ammoniak |
| Dampdruk | Niet van toepassing (polyatomair ion) |
| Dampdichtheid | Niet van toepassing (polyatomair ion) |
| pKa | 9,25 (geconjugeerd zuur, ammoniumkation) |
| pH | 7 (neutraal) in waterige oplossing |
Opmerking: De waarden in de tabel kunnen variëren afhankelijk van de chemische vorm en specifieke omstandigheden van het ammoniumion.
Veiligheid en gevaren van ammoniumionen
Het ammoniumion wordt in zijn pure vorm over het algemeen als veilig en niet-giftig beschouwd. Zoals veel chemische verbindingen kan ammoniumion echter bepaalde gevaren en risico’s met zich meebrengen, vooral als het op de juiste manier wordt behandeld of gebruikt. Het ammoniumion kan giftig ammoniakgas vrijgeven wanneer het reageert met sterke basen of sterke zuren. Het kan ook brand- en explosiegevaar opleveren bij blootstelling aan hitte of vlammen. Bovendien kan blootstelling aan hoge concentraties ammoniumionen of derivaten daarvan irritatie aan de ogen, huid en luchtwegen veroorzaken. Het is belangrijk om de juiste veiligheidsprotocollen te volgen en voorzichtig om te gaan met ammoniumionen en zijn derivaten om potentiële gevaren te voorkomen.
| Gevarensymbolen | Geen toegewezen voor zuiver ammoniumion |
| Beveiligingsbeschrijving | Schadelijk bij inslikken, inademen of opname via de huid. Veroorzaakt irritatie aan de huid, ogen en luchtwegen. Er kan giftig ammoniakgas vrijkomen. Kan brand- en explosiegevaar met zich meebrengen. |
| EEN ID | 3077 (voor ammoniumverbindingen, inclusief ammoniumzouten) |
| HS-code | 2827.10.00 (voor ammoniumchloride, ammoniumcarbonaat en andere ammoniumzouten) |
| Gevarenklasse | 9 (Diverse gevaarlijke stoffen en voorwerpen) voor ammoniumverbindingen, Klasse 8 (Bijtende stoffen) voor ammoniumhydroxideoplossing |
| Verpakkingsgroep | III (voor ammoniumverbindingen) |
| Toxiciteit | Over het algemeen beschouwd als niet-giftig in zijn pure vorm, maar er kan giftig ammoniakgas vrijkomen. Ammoniumverbindingen en derivaten kunnen giftig of schadelijk zijn voor de menselijke gezondheid en het milieu, afhankelijk van hun specifieke eigenschappen en gebruik. |
Methoden voor de synthese van ammoniumionen
Ammoniumionen kunnen worden gesynthetiseerd met behulp van verschillende methoden, waaronder chemische reacties en biologische processen.
Een gebruikelijke methode voor het synthetiseren van het ammoniumion is het laten reageren van ammoniakgas met een zuur, zoals zoutzuur of zwavelzuur, om ammoniumzout te produceren. De reactie omvat de verplaatsing van waterstofionen (H+) in het zuur door ammoniakmoleculen, resulterend in de vorming van ammoniumkationen (NH4+) en het overeenkomstige anion van het zuur (bijvoorbeeld chloride, sulfaat). Het resulterende ammoniumzout kan worden gezuiverd en gekristalliseerd om een ammoniumion te verkrijgen.
Biologische processen, zoals de afbraak van organisch materiaal door microben, kunnen ook resulteren in de vorming van ammoniumionen. Tijdens dit proces worden stikstofhoudende verbindingen afgebroken door bacteriën en andere micro-organismen, waarbij ammoniak en uiteindelijk ammoniumionen ontstaan. Dit proces heet ammonificatie en is een belangrijke stap in de stikstofcyclus.
Een andere methode om het ammoniumion te synthetiseren is het gebruik van het Haber-Bosch-proces, waarbij stikstofgas en waterstofgas reageren in aanwezigheid van een katalysator bij hoge druk en temperatuur. Het resulterende ammoniakgas kan vervolgens reageren met een zuur om een ammoniumion te produceren.
Gebruik van ammoniumionen
Het ammoniumion heeft verschillende toepassingen in industriële, agrarische en laboratoriumomgevingen.
Het dient een breed scala aan industriële, agrarische en laboratoriumomgevingen, omdat het voornamelijk als meststof in de landbouw fungeert, waarbij het direct beschikbare stikstof aan planten levert en de pH van de bodem verlaagt.
De chemische industrie gebruikt het ammoniumion als een belangrijk ingrediënt bij de productie van verschillende verbindingen, zoals meststoffen, explosieven en farmaceutische producten, maar ook bij de synthese van antibiotica en andere farmaceutische producten. Het ammoniumion functioneert ook als explosief in de vorm van ammoniumnitraat.
In laboratoria gebruiken onderzoekers het ammoniumion als reactant bij veel chemische reacties, zoals neerslagreacties en organische synthese, en als buffermiddel om de pH van de oplossing te stabiliseren.
Bovendien wordt ammoniumion in huishoudelijke schoonmaakproducten gebruikt als antimicrobieel middel vanwege het vermogen om bacteriën en schimmels te doden.
De vele toepassingen van het ammoniumion en zijn veelzijdigheid maken het tot een essentiële verbinding in verschillende industrieën en toepassingen.
