NH4OH of ammoniumhydroxide is een heldere, kleurloze oplossing die algemeen bekend staat als huishoudelijke ammoniak. Het is een sterk alkalische oplossing met een pH van 11-12. Het wordt gebruikt als reinigingsmiddel, bij de productie van kunstmest en in sommige voedseltoepassingen als vertrekkend middel.
| IUPAC-naam | Ammoniumhydroxide |
| Moleculaire formule | NH4OH |
| CAS-nummer | 1336/21/6 |
| Synoniemen | Ammoniakoplossing, waterige ammoniak, huishoudelijke ammoniak |
| InChi | InChI=1S/H5NO/c1-5(2,3)4/h(H,1,2,3,4)/p+1 |
Eigenschappen van ammoniumhydroxide
Ammoniumhydroxide-formule
De chemische formule voor ammoniumhydroxide is NH4OH. De formule vertegenwoordigt het relatieve aantal en de soorten atomen in de verbinding. De “N” staat voor stikstof, “H” staat voor waterstof en “O” staat voor zuurstof. De indexnummers in de formule geven het aantal atomen van elk element in de verbinding aan. In het geval van ammoniumhydroxide zijn er één stikstofatoom, vier waterstofatomen en één zuurstofatoom. De formule van ammoniumhydroxide vertegenwoordigt de ionische verbinding, die is samengesteld uit positief geladen ammoniumionen (NH4+) en negatief geladen hydroxide-ionen (OH-).
Ammoniumhydroxide Ph
De pH van ammoniumhydroxide (NH4OH) is basisch, met een waarde van ongeveer 11. Dit betekent dat ammoniumhydroxide een hoge concentratie hydroxide-ionen (OH-) heeft en zeer alkalisch is. De pH van ammoniumhydroxideoplossingen kan variëren afhankelijk van de concentratie, temperatuur en andere factoren, maar wordt over het algemeen als een sterke base beschouwd met een pH boven 7,0. Ammoniumhydroxide wordt vaak gebruikt in verschillende industriële en huishoudelijke toepassingen, zoals reiniging en pH-aanpassing, vanwege de hoge alkaliteit. Het is echter belangrijk om voorzichtig om te gaan met ammoniumhydroxide, omdat het bijtend en gevaarlijk kan zijn als het niet op de juiste manier wordt behandeld.
Ammoniumhydroxide SDS
MSDS staat voor Material Safety Data Sheet, een document dat informatie geeft over de eigenschappen, hantering, opslag en verwijdering van een chemische stof. Een MSDS voor ammoniumhydroxide (NH4OH) zou informatie verschaffen over de fysische en chemische eigenschappen ervan, mogelijke gevolgen voor de gezondheid, brand- en explosiegevaren, en eventuele beschermende maatregelen die genomen moeten worden bij het hanteren of gebruiken van de stof.
Het MSDS voor ammoniumhydroxide zou ook informatie bevatten over de toxiciteit, reactiviteit en ontvlambaarheid ervan, evenals eventuele passende eerstehulpmaatregelen in geval van blootstelling. Bovendien zou het MSDS informatie verschaffen over de juiste opslag en verwijdering van ammoniumhydroxide, inclusief eventuele noodzakelijke voorzorgsmaatregelen om morsen of lekken te voorkomen.
Oplosbaarheid van ammoniumhydroxide
Ammoniumhydroxide (NH4OH) is zeer oplosbaar in water. Het vormt een heldere, kleurloze, sterk alkalische oplossing met een karakteristieke geur. De oplosbaarheid van ammoniumhydroxide in water hangt af van de temperatuur en de concentratie, waarbij hogere temperaturen en concentraties resulteren in een verhoogde oplosbaarheid.
Over het algemeen lost ammoniumhydroxide gemakkelijk op in water, waardoor een neutrale tot alkalische oplossing ontstaat met een pH van ongeveer 9 tot 11. De oplosbaarheid van ammoniumhydroxide in water wordt ook beïnvloed door andere factoren zoals druk, temperatuur en de aanwezigheid van andere factoren. opgeloste stoffen.
Molaire massa ammoniumhydroxide
De molmassa van ammoniumhydroxide (NH4OH) is 35,05 g/mol. Deze waarde is belangrijk voor het bepalen van de hoeveelheid ammoniumhydroxide in een monster, maar ook voor chemische reacties waarbij de verbinding betrokken is. Om de molaire massa van een stof te bepalen, worden de atoomgewichten van alle elementen in de verbinding bij elkaar opgeteld. In het geval van ammoniumhydroxide wordt de molmassa berekend door de atoomgewichten van stikstof (14,01 g/mol), waterstof (1,01 g/mol) en zuurstof (16,00 g/mol) op te tellen.
Kookpunt van ammoniumhydroxide
Het kookpunt van ammoniumhydroxide is ongeveer 38°C. Deze waarde is belangrijk bij het bepalen van de omstandigheden waaronder de verbinding zal veranderen van een vloeistof in een gas. Vind het kookpunt van ammoniumhydroxide door de dampspanning van de stof te meten. Dampspanning is de druk die damp uitoefent boven vloeistof in een gesloten container. Houd er rekening mee dat het kookpunt ook kan veranderen afhankelijk van de druk en temperatuur.
Smeltpunt van ammoniumhydroxide
Het smeltpunt van ammoniumhydroxide is -77°C. Deze waarde is belangrijk bij het bepalen van de omstandigheden waaronder de verbinding zal veranderen van vast naar vloeibaar. Meet het smeltpunt van ammoniumhydroxide door de sterkte van de intermoleculaire bindingen te beoordelen. Houd er rekening mee dat het smeltpunt kan variëren afhankelijk van de druk en temperatuur van de omgeving.
Dichtheid van ammoniumhydroxide g/ml
De dichtheid van ammoniumhydroxide is ongeveer 0,91 g/ml. Deze waarde is belangrijk voor het bepalen van de hoeveelheid ammoniumhydroxide in een bepaald volume, maar ook voor het berekenen van de massa van de stof in een bepaald volume. Bepaal de dichtheid van ammoniumhydroxide door de massa te delen door het volume dat het inneemt. Houd er rekening mee dat de dichtheid van een stof kan veranderen afhankelijk van temperatuur en druk.
Ammoniumhydroxide Molecuulgewicht
Het molecuulgewicht van ammoniumhydroxide is 35,05 g/mol. Deze waarde is belangrijk voor het bepalen van de hoeveelheid ammoniumhydroxide in een monster, maar ook voor chemische reacties waarbij de verbinding betrokken is. Bereken het molecuulgewicht van ammoniumhydroxide door de atoomgewichten van stikstof (14,01 g/mol), waterstof (1,01 g/mol) en zuurstof (16,00 g/mol) op te tellen.
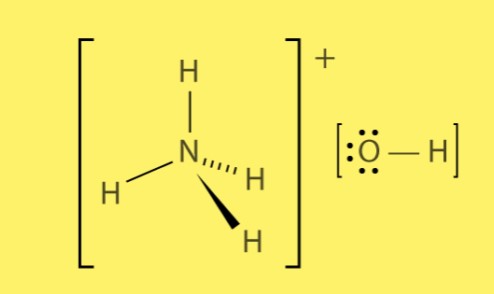
Structuur van ammoniumhydroxide
Ammoniumhydroxide wordt gevormd uit de combinatie van positief geladen ammoniumionen (NH4+) en negatief geladen hydroxide-ionen (OH-). De ionische bindingen tussen deze ionen creëren een sterke elektrostatische aantrekkingskracht, wat leidt tot de vorming van de verbinding.
| Verschijning | Heldere, kleurloze vloeistof |
| Soortelijk gewicht | 0,91 g/ml |
| Kleur | Kleurloos |
| Geur | Scherpe geur, vergelijkbaar met ammoniak |
| Molaire massa | 35,05 g/mol |
| Dikte | 0,91 g/ml |
| Fusie punt | -77°C |
| Kookpunt | 38°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Volledig oplosbaar |
| Oplosbaarheid | Oplosbaar in ethanol en methanol |
| Dampdruk | 17,5 mmHg bij 20°C |
| Dampdichtheid | 0,6 (lucht = 1) |
| pKa | 10.64 |
| pH | 11.6 (1M-oplossing) |
Veiligheid en gevaren van ammoniumhydroxide
Ammoniumhydroxide is een sterk alkalische oplossing en kan gevaarlijk zijn als er verkeerd mee wordt omgegaan. Bij inademing kan het huid- en oogirritatie en ademhalingsproblemen veroorzaken. Bij contact met de huid overvloedig water geven en indien nodig een arts raadplegen. Als het wordt ingeslikt, kan het ernstig letsel of de dood veroorzaken. Het is daarom belangrijk om het buiten bereik van kinderen en huisdieren te bewaren. Het is ook brandbaar en moet uit de buurt van warmtebronnen en vlammen worden gehouden. Bij gebruik van ammoniumhydroxide is het belangrijk om beschermende uitrusting te dragen, zoals handschoenen en oogbescherming. Indien gemorst, neutraliseer met zuur en ruim op met voldoende ventilatie. Het in acht nemen van veiligheidsmaatregelen en een juiste opslag zijn essentieel bij het hanteren van ammoniumhydroxide.
| Gevarensymbolen | Bijtend |
| Beveiligingsbeschrijving | S26, S37/39 |
| VN-identificatienummers | VN2672 |
| HS-code | 2814.10.00 |
| Gevarenklasse | 8 |
| Verpakkingsgroep | II |
| Toxiciteit | Schadelijk bij inslikken, inademen of bij contact met de huid. Kan ernstige irritatie en brandwonden veroorzaken. |
Methoden voor de synthese van ammoniumhydroxide
Ammoniumhydroxide kan op twee manieren worden gesynthetiseerd: het ammoniumchlorideproces en het ammoniakproces.
Het ammoniumchlorideproces omvat de reactie van ammoniakgas en zoutzuur, waarbij ammoniumchloride en water worden geproduceerd:
NH3 + HCl → NH4Cl + H2O
Het ammoniumchloride wordt vervolgens opgelost in water om een ammoniumhydroxideoplossing te produceren. Deze oplossing kan verder worden geconcentreerd door destillatie om een geconcentreerde oplossing van ammoniumhydroxide te produceren.
Het ammoniakproces omvat de directe reactie van ammoniakgas en water, waarbij ammoniumhydroxide en waterstofgas worden geproduceerd:
NH3 + H2O → NH4OH + H2
De productie van ammoniumhydroxide kan worden gecontroleerd door de temperatuur en druk aan te passen tijdens de exotherme reactie, wat resulteert in een oplossing die kan worden gezuiverd en geconcentreerd door middel van was- en destillatietechnieken. Bij de industriële productie van ammoniumhydroxide wordt gewoonlijk gebruik gemaakt van het ammoniakproces vanwege de eenvoud en efficiëntie ervan, maar het ammoniumchlorideproces dient als back-upoptie bij ammoniaktekorten.
Gebruik van ammoniumhydroxide
Ammoniumhydroxide heeft vele toepassingen in verschillende industrieën. Enkele veel voorkomende toepassingen zijn:
- In diverse huishoudelijke en industriële toepassingen wordt ammoniumhydroxide gebruikt als reinigingsmiddel om vet, olie en vuil effectief van oppervlakken te verwijderen.
- In de voedingsindustrie wordt het gebruikt als desinfectiemiddel om bacteriën en ziekteverwekkers op oppervlakken die met voedsel in contact komen te doden. In de landbouw levert ammoniumhydroxide essentiële stikstof als meststof voor de plantengroei en is het een belangrijk ingrediënt bij de productie van ammoniumnitraatmeststof.
- In de farmaceutische industrie wordt het gebruikt bij de productie van bepaalde medicijnen en als pH-regelaar bij de vervaardiging van bepaalde medische producten.
- De bakindustrie gebruikt ammoniumhydroxide als rijsmiddel om deeg te laten rijzen, en het fungeert ook als smaakstof in sommige voedingsproducten en als pH-regelaar bij de productie van sommige voedingsmiddelen en dranken.
- In de textielindustrie neutraliseert ammoniumhydroxide zuren en past het de pH-waarden bij de textielproductie aan. Bij waterbehandeling past het de pH-waarde aan en verwijdert het onzuiverheden.
Over het geheel genomen is ammoniumhydroxide een veelzijdige en veelgebruikte chemische stof, met toepassingen in verschillende industrieën. Het is echter belangrijk om veilig met ammoniumhydroxide om te gaan, omdat het gevaarlijk kan zijn als het niet op de juiste manier wordt gebruikt.
Vragen:
Is ammoniumhydroxide oplosbaar?
Ja, ammoniumhydroxide is zeer oplosbaar in water. Het vormt een heldere, kleurloze, sterk alkalische oplossing met een karakteristieke geur. De oplosbaarheid van ammoniumhydroxide in water hangt af van de temperatuur en de concentratie, waarbij hogere temperaturen en concentraties resulteren in een verhoogde oplosbaarheid.
Wat is de chemische formule voor ammoniumhydroxide?
De chemische formule voor ammoniumhydroxide is NH4OH.
Wat is de formule voor ammoniumhydroxide?
De formule voor ammoniumhydroxide is NH4OH.
Is ammoniumhydroxide een sterke base?
Ja, ammoniumhydroxide wordt als een sterke base beschouwd. Het dissocieert volledig in water en vormt hydroxide-ionen (OH-) en ammoniumionen (NH4+), waardoor het zeer alkalisch wordt met een pH van ongeveer 11. Deze hoge alkaliteit maakt het een nuttige chemische stof in diverse industriële en huishoudelijke toepassingen, zoals schoonmaak- en schoonmaakwerkzaamheden. pH-aanpassing. Het is echter belangrijk om voorzichtig om te gaan met ammoniumhydroxide, omdat het bijtend en gevaarlijk kan zijn als het niet op de juiste manier wordt behandeld.
samengestelde naam nh4oh
De naam van de chemische verbinding van NH4OH is ammoniumhydroxide.
naam nh4oh
De naam van NH4OH is ammoniumhydroxide.
