Ammoniumbifluoride (NH5F2) is een chemische verbinding. Het lost op in water en vormt fluorwaterstofzuur. Het kan glas aantasten en metalen aantasten.
| Naam van IUPAC | Waterstofammoniumfluoride |
| Moleculaire formule | [NH4] [HF2] |
| CAS-nummer | 1341/49/7 |
| Synoniemen | Ammoniumzuurfluoride, ammoniumhydrofluoride, ammoniumdifluoride, ammoniumwaterstofdifluoride, ammoniumwaterstofdifluoride |
| InChi | InChI=1S/F2H.H3N/c1-3-2;/h;1H3/q-1;/p+1 |
Eigenschappen van ammoniumbifluoride
Ammoniumbifluoride-formule
De formule voor ammoniumbifluoride is [NH4][HF2] of [NH4]F·HF. Dit geeft aan dat de verbinding een ammoniumkation ([NH4]+) en een bifluoride- of waterstof(difluoride) anion ([HF2]−) bevat. De formule kan ook worden geschreven als NH5F2, wat het aantal atomen van elk element in de verbinding aangeeft.
Ammoniumbifluoride Molaire massa
De molaire massa van ammoniumdifluoride is 57,044 g/mol. Het wordt berekend door de atoommassa’s van de elementen in de formule op te tellen: (14,007 + 4 × 1,008) + (2 × 18,998) = 57,044 g/mol.
Kookpunt van ammoniumbifluoride
Het kookpunt van ammoniumdifluoride is 240 ° C (464 ° F; 513 K). De verbinding ontleedt echter voordat deze temperatuur wordt bereikt, waarbij ammoniak en waterstoffluoridegassen vrijkomen 1 . Daarom heeft ammoniumdifluoride geen echt kookpunt.
Ammoniumbifluoride Smeltpunt
Het smeltpunt van ammoniumdifluoride is 126 ° C (259 ° F; 399 K). Dit is de temperatuur waarbij de vaste verbinding in een vloeistof verandert. Het smeltpunt hangt af van de sterkte van de intermoleculaire krachten tussen de moleculen van de verbinding.
Dichtheid van ammoniumbifluoride g/ml
De dichtheid van ammoniumdifluoride is 1,50 g/ml. Het is de massa van de verbinding per volume-eenheid. De dichtheid kan worden gemeten door de massa van een monster te delen door het volume. De dichtheid van een stof hangt af van de moleculaire structuur en verpakking ervan.
Ammoniumbifluoride Molecuulgewicht
Het molecuulgewicht van ammoniumdifluoride is 57,044 g/mol. Dit is hetzelfde als de molaire massa van de verbinding. Het molecuulgewicht kan worden gebruikt om het aantal mol van een stof in een bepaalde massa of volume te berekenen.
Structuur van ammoniumbifluoride
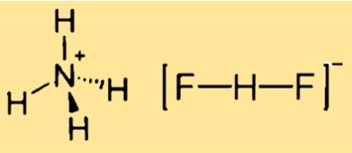
De structuur van ammoniumdifluoride is kubisch, gerelateerd aan de CsCl-structuur. Dit betekent dat de verbinding een kristalrooster heeft met een kubieke eenheidscel, waarbij elk ammoniumkation omgeven is door vier fluoridecentra in een tetraëder, en elk difluoride-anion lineair is. De structuur kan worden weergegeven door een driedimensionaal model of een tweedimensionaal diagram.
Oplosbaarheid van ammoniumbifluoride
De oplosbaarheid van ammoniumdifluoride in water is 63 g/100 ml bij 20°C. Dit betekent dat bij deze temperatuur 63 gram van de verbinding kan oplossen in 100 milliliter water. De oplosbaarheid hangt af van de polariteit en het waterstofbruggend vermogen van de verbinding en het oplosmiddel.
| Verschijning | Kleurloze kristallen of wit kristal |
| Specifieke dichtheid | 1,50 |
| Kleur | Kleurloos |
| Geur | Licht kruidig, kruidig |
| Molaire massa | 57,044 g/mol |
| Dikte | 1,50 g/cm3 |
| Fusie punt | 126°C (259°F; 399K) |
| Kookpunt | 240 ° C (464 ° F; 513 K) (ontleedt) |
| Flitspunt | Niet vlambaar |
| oplosbaarheid in water | 63g/100ml (20°C) |
| Oplosbaarheid | Enigszins oplosbaar in alcohol, onoplosbaar in vloeibare ammoniak |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Niet beschikbaar |
Veiligheid en gevaren van ammoniumbifluoride
Ammoniumdifluoride is een giftige en bijtende chemische stof die schadelijk kan zijn als u het inslikt, inademt of aanraakt. Het kan ernstige brandwonden en oogletsel, neusbloedingen, hoesten, piepende ademhaling, kortademigheid, misselijkheid, braken en verlies van eetlust veroorzaken. Bij verhitting kan er ook waterstoffluoride vrijkomen, wat zeer gevaarlijk is om in te ademen. U moet contact met deze chemische stof vermijden en beschermende handschoenen, kleding, oog- en gezichtsbescherming dragen wanneer u ermee werkt. Als u wordt blootgesteld, moet u onmiddellijk met water afspoelen en medische hulp inroepen. Verontreinigde kleding moet u ook wassen voordat u deze opnieuw gebruikt.
| Gevarensymbolen | T, C |
| Beveiligingsbeschrijving | S26, S36/37/39, S45 |
| VN-identificatienummers | UN 1727 (vast), UN 2817 (oplossing) |
| HS-code | 2826.19 |
| Gevarenklasse | 8 |
| Verpakkingsgroep | II |
| Toxiciteit | Orale LD50 (rat) = 200 mg/kg |
Methoden voor de synthese van ammoniumbifluoride
Er worden verschillende methoden gebruikt om ammoniumdifluoride, een anorganisch zout, te bereiden. Enkele veel voorkomende methoden zijn:
- Dampfaseproces: deze methode omvat de reactie van ammoniakgas en waterstoffluoridegas bij hoge temperaturen en druk. Het product is een droog en zuiver ammoniumdifluoridepoeder. Deze methode vereist echter complexe apparatuur en hoge investeringen.
- Vloeistoffasemethode: Deze methode omvat de reactie van waterige oplossingen van ammoniak en waterstoffluoride of ammoniumfluoride en waterstoffluoride bij gematigde temperatuur en druk. Het product is een vochtig, minder zuiver ammoniumdifluoridekristal. Mensen gebruiken deze methode op grote schaal omdat deze eenvoudig is, maar het product van slechte kwaliteit is en de neiging heeft vocht en cake te absorberen.
- Neutralisatiemethode: Deze methode omvat de reactie van een onverzadigde oplossing van ammoniumfluoride en fluorwaterstofzuur , gevolgd door de toevoeging van ammoniakoplossing om de overmaat fluorwaterstofzuur te neutraliseren. Het product is een relatief zuiver en stabiel ammoniumdifluoridekristal. Deze methode kan de productkwaliteit verbeteren en de milieuvervuiling verminderen.
Gebruik van ammoniumbifluoride
Ammoniumdifluoride is een anorganisch zout dat verschillende toepassingen heeft in verschillende industrieën. Enkele veel voorkomende toepassingen zijn:
- Glas etsen: Ammoniumdifluoride kan de silicacomponent van glas aantasten en patronen of ontwerpen op het oppervlak creëren. Het kan ook vlekken en roest van glaswerk verwijderen.
- Metaalverwerking: Ammoniumdifluoride kan als complexvormer werken bij bepaalde metalen en de kwaliteit en het uiterlijk van galvaniseren verbeteren. Het kan ook oxiden en aanslag van metalen oppervlakken verwijderen.
- Keramische productie: gebruikt als vloeimiddel bij de bereiding van keramische glazuren en emails. Het kan ook het smeltpunt en de viscositeit van bepaalde keramische materialen verlagen.
- Organische synthese: Gebruikt als katalysator of reagens bij bepaalde organische reacties, zoals fluorering, ontscherming en splitsing.
- Minerale vertering: Wordt ook gebruikt als krachtig fluoreringsmiddel om bepaalde mineralen en vuurvaste oxiden om te zetten in oplosbare fluoriden. Dit kan de terugwinning van edele metalen uit ertsen vergemakkelijken.
Vragen:
Vraag: Wat is de bulkdichtheid van ammoniumbifluoridezouten?
A: De bulkdichtheid van ammoniumdifluoridezouten is 1,5 g/cm3.
Vraag: Waar wordt ammoniumbifluoride voor gebruikt?
A: Ammoniumdifluoride wordt voor verschillende doeleinden gebruikt, zoals glasetsen, metaalverwerking, keramische productie, organische synthese en mineralenvertering.
Vraag: Hoe glas etsen met ammoniumbifluoride?
A: Om glas te etsen met ammoniumdifluoride, moet u een oplossing van zout in water bereiden en deze met een penseel of stencil op het glasoppervlak aanbrengen. De oplossing reageert met de silicacomponent van het glas en creëert patronen of ontwerpen. U moet het glas na het etsen met water afspoelen en drogen.
Vraag: Is ammoniumbifluoride veilig op chromen wielen?
A: Ammoniumdifluoride is niet veilig op chromen velgen omdat het het metaal kan aantasten en de afwerking kan beschadigen. Het kan ook ernstige brandwonden en oogletsel veroorzaken als het in contact komt met de huid of ogen. Vermijd het gebruik van ammoniumdifluoride op chromen velgen en gebruik in plaats daarvan een geschikt schoonmaakmiddel.
Vraag: Wat is de houdbaarheid van ammoniumbifluoride?
A: De houdbaarheid van ammoniumdifluoride hangt af van de opslagomstandigheden en de zuiverheid van het product. Over het algemeen kan het meerdere jaren meegaan als het wordt bewaard in een koele, droge, goed geventileerde ruimte in een goed gesloten container. Het kan echter vocht uit de lucht opnemen en na verloop van tijd klonten of cakes vormen. U moet het uiterlijk en de kwaliteit van het product controleren voordat u het gebruikt.
Vraag: Is ammoniumbifluoride een zuur?
A: Ammoniumdifluoride is geen zuur, maar een zout dat een ammoniumkation ([NH4]+) en een difluoride- of waterstof(difluoride) anion ([HF2]−) bevat. Het kan echter werken als een zuur-baseverbinding, omdat het waterstoffluoride (HF), een sterk zuur, kan afgeven bij verhitting of oplossing in water.
