Ammoniumbicarbonaat is een witte kristallijne verbinding die bij het bakken als vertrekkend middel wordt gebruikt. Bij verhitting komt er kooldioxide vrij, wat resulteert in lichte en luchtige bakproducten.
| IUPAC-naam | Ammoniumbicarbonaat |
| Moleculaire formule | NH4HCO3 |
| CAS-nummer | 1066-33-7 |
| Synoniemen | Zuur ammoniumcarbonaat; bakkerij ammoniak; Ammoniumzout van koolzuur (1:1); Ammoniumwaterstofcarbonaat |
| InChi | InChI=1S/CH2O3.H3N/c2-1(3)4;/h(H2,2,3,4);1H3 |
Houd er rekening mee dat de opgegeven InChI-waarde een vereenvoudigde weergave is en mogelijk niet volledig is.
Eigenschappen van ammoniumbicarbonaat
Formule van ammoniumbicarbonaat
De chemische formule voor ammoniumbicarbonaat is NH4HCO3. Het bestaat uit een ammoniumion (NH4+) en een bicarbonaation (HCO3-). Deze formule vertegenwoordigt de samenstelling van de verbinding en geeft de aanwezigheid van ammonium- en bicarbonaatgroepen aan.
Molaire massa van ammoniumbicarbonaat
De molaire massa van ammoniumwaterstofcarbonaat wordt berekend door de atoommassa’s van de samenstellende elementen op te tellen. Voor ammoniumwaterstofcarbonaat (NH4HCO3) bedraagt de molaire massa ongeveer 79,06 gram per mol. Deze waarde is belangrijk voor verschillende chemische berekeningen en conversies.
Kookpunt van ammoniumbicarbonaat
Ammoniumwaterstofcarbonaat heeft geen duidelijk kookpunt, omdat het bij verhitting uiteenvalt in gasvormige producten. Het ontbindingsproces begint echter rond de 60 tot 70 graden Celsius. Naarmate de temperatuur stijgt, valt de verbinding uiteen in ammoniak (NH3), water (H2O) en kooldioxide (CO2).
Smeltpunt van ammoniumbicarbonaat
Het smeltpunt van ammoniumwaterstofcarbonaat is ongeveer 41 tot 60 graden Celsius. Bij verhitting ondergaat de verbinding sublimatie, waarbij deze rechtstreeks van een vaste stof naar een gas gaat zonder de vloeibare fase te passeren.
Dichtheid van ammoniumbicarbonaat g/ml
De dichtheid van ammoniumwaterstofcarbonaat is ongeveer 1,59 gram per milliliter (g/ml) bij kamertemperatuur. Deze waarde vertegenwoordigt de massa van de verbinding per volume-eenheid. De dichtheid van ammoniumwaterstofcarbonaat beïnvloedt het gedrag ervan in verschillende toepassingen en de oplosbaarheid ervan in verschillende oplosmiddelen.
Ammoniumbicarbonaat Molecuulgewicht
Het molecuulgewicht van ammoniumwaterstofcarbonaat is ongeveer 79,06 gram per mol. Deze waarde wordt verkregen door de atoommassa’s van de elementen die in de verbinding aanwezig zijn (stikstof, waterstof, koolstof en zuurstof) op te tellen. Het molecuulgewicht is essentieel voor het berekenen van de hoeveelheid ammoniumwaterstofcarbonaat die nodig is voor chemische reacties.
Structuur van ammoniumbicarbonaat
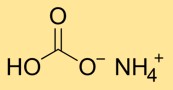
Ammoniumwaterstofcarbonaat heeft een kristalstructuur die bestaat uit ammonium- (NH4+) en bicarbonaat- (HCO3-)-ionen. Het ammoniumion wordt gevormd door de combinatie van één stikstofatoom en vier waterstofatomen, terwijl het bicarbonaation bestaat uit één koolstofatoom gebonden aan drie zuurstofatomen.
Oplosbaarheid van ammoniumbicarbonaat
Ammoniumwaterstofcarbonaat is zeer oplosbaar in water. Het lost gemakkelijk op in waterige oplossingen, waarbij ammoniumionen en bicarbonaationen vrijkomen. De oplosbaarheid neemt echter af met de temperatuur. Het is slecht oplosbaar in alcohol en onoplosbaar in de meeste organische oplosmiddelen.
| Verschijning | Wit kristallijn poeder |
| Soortelijk gewicht | 1.586 g/cm³ |
| Kleur | Kleurloos |
| Geur | Ammoniak geur |
| Molaire massa | 79,06 g/mol |
| Dikte | 1,59 g/ml |
| Fusie punt | 41-60°C |
| Kookpunt | Ontbonden |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Oplosbaar |
| Oplosbaarheid | Oplosbaar in water; slecht oplosbaar in alcohol |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | ~7 |
Houd er rekening mee dat de opgegeven waarden bij benadering zijn en kunnen variëren afhankelijk van factoren zoals zuiverheid en omgevingsomstandigheden.
Veiligheid en gevaren van ammoniumbicarbonaat
Ammoniumwaterstofcarbonaat brengt bepaalde veiligheidsoverwegingen en gevaren met zich mee. Het kan de ogen, huid en luchtwegen irriteren bij contact of inademing. Directe blootstelling kan ongemak veroorzaken, inclusief een branderig gevoel. Het is belangrijk om voorzichtig met het mengsel om te gaan en geschikte persoonlijke beschermingsmiddelen te gebruiken, zoals handschoenen en een veiligheidsbril. Bovendien kan ammoniumwaterstofcarbonaat bij verhitting schadelijk ammoniakgas afgeven, dus in dergelijke situaties is voldoende ventilatie noodzakelijk. De verbinding is niet brandbaar en heeft geen specifiek vlampunt. Een juiste opslag, etikettering en naleving van veiligheidsprotocollen zijn essentieel om de risico’s die gepaard gaan met de hantering en het gebruik van ammoniumwaterstofcarbonaat te minimaliseren.
| Gevarensymbolen | Xi (irriterend) |
| Beveiligingsbeschrijving | – Vermijd contact met de ogen, huid en inademing.\n- Gebruik geschikte persoonlijke beschermingsmiddelen.\n- Zorg voor voldoende ventilatie tijdens het hanteren.\n- Bewaar op de juiste manier en etiketteer containers.\n – Volg de veiligheidsprotocollen. |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | 28369990 |
| Gevarenklasse | Niet geclassificeerd |
| Verpakkingsgroep | Niet geclassificeerd |
| Toxiciteit | Lage toxiciteit; irriterend voor de ogen, de huid en de luchtwegen. |
Houd er rekening mee dat de verstrekte informatie algemeen van aard is en mogelijk niet alle aspecten van de veiligheid en gevaren van ammoniumwaterstofcarbonaat dekt. Het is belangrijk om specifieke veiligheidsinformatiebladen en voorschriften te raadplegen voor volledige richtlijnen.
Methoden voor de synthese van ammoniumbicarbonaat
Er zijn verschillende methoden voor het synthetiseren van ammoniumwaterstofcarbonaat.
Een veelgebruikte methode is de reactie tussen gasvormige ammoniak (NH3) en kooldioxide (CO2) in een waterige oplossing. Bij dit proces borrel je de twee gassen rechtstreeks in het water en vormt het water een ammoniumwaterstofcarbonaatoplossing. Vervolgens concentreer en kristalliseer je de oplossing om de vaste verbinding te verkrijgen.
Een andere benadering is de reactie tussen ammoniak en kooldioxide in een oplosmiddel, zoals methanol of ethanol. De reactie vindt plaats onder druk en bij hoge temperatuur, wat resulteert in de vorming van ammoniumwaterstofcarbonaatkristallen.
Door ammoniumcarbonaat te behandelen met kooldioxide ontstaat ammoniumbicarbonaat en water. Ammoniumcarbonaat , zowel in vaste vorm als in oplossing, reageert met kooldioxide om ammoniumbicarbonaat te produceren.
Om ammoniumwaterstofcarbonaat te synthetiseren, kan ammoniak worden gecombineerd met koolzuur. Koolzuur wordt gevormd door kooldioxide in water op te lossen, en door ammoniak aan de resulterende koolzuuroplossing toe te voegen ontstaat ammoniumwaterstofcarbonaat.
Zorg ervoor dat de synthese van ammoniumwaterstofcarbonaat plaatsvindt in een goed geventileerde ruimte vanwege het vrijkomen van ammoniakgas tijdens de reacties. Volg de juiste veiligheidsmaatregelen en hanteringsprotocollen om een veilig en efficiënt syntheseproces te garanderen.
Gebruik van ammoniumbicarbonaat
Ammoniumwaterstofcarbonaat vindt verschillende toepassingen in verschillende industrieën en toepassingen. Hier zijn enkele veelvoorkomende toepassingen:
- Bakken: Ammoniumwaterstofcarbonaat wordt gebruikt als rijsmiddel bij het bakken, vooral voor koekjes, crackers en andere bakproducten. Bij verhitting komt er kooldioxide vrij, waardoor een lichte, knapperige textuur ontstaat.
- Ammoniakproductie: Ammoniumwaterstofcarbonaat dient als tussenproduct bij de productie van ammoniak. Het kan worden afgebroken tot ammoniak en kooldioxide, die vervolgens kunnen worden gescheiden en voor verschillende doeleinden kunnen worden gebruikt.
- Landbouw: Boeren gebruiken het als stikstofbron in meststoffen om essentiële voedingsstoffen voor de plantengroei te leveren. Planten nemen het gemakkelijk op dankzij de oplosbaarheid in water.
- pH-controle: Industrieën gebruiken ammoniumwaterstofcarbonaat om de pH-niveaus aan te passen in processen zoals waterbehandeling, kleurstofproductie en pigmentproductie.
- Brandblussers: Sommige droogpoederbrandblussers gebruiken deze verbinding als brandblusser. Het dooft de vlammen en verstoort het verbrandingsproces.
- Reinigingsmiddel: Sommige industrieën gebruiken het als reinigingsmiddel om vuil, vet en verontreinigingen van oppervlakken te verwijderen.
- Textiel- en leerindustrie: Bij de verf- en drukprocessen van textiel en lederwaren helpt ammoniumwaterstofcarbonaat om kleurstoffen te fixeren en de kleurechtheid te verbeteren.
- Farmaceutische toepassingen: Het vindt toepassing in bepaalde farmaceutische formuleringen als buffermiddel of ingrediënt in medicinale tabletten.
De diverse toepassingen van ammoniumwaterstofcarbonaat benadrukken de veelzijdigheid en bruikbaarheid ervan in meerdere industrieën, waaronder bakken, landbouw, pH-controle, brandbestrijding en verschillende productieprocessen.
Vragen:
Vraag: Is ammoniumbicarbonaat slecht voor u?
A: Ammoniumwaterstofcarbonaat kan schadelijk zijn als het in grote hoeveelheden wordt ingeslikt of ingeademd, waardoor irritatie van de luchtwegen en de huid ontstaat. Het moet met passende voorzorgsmaatregelen worden behandeld en gebruikt.
Vraag: Hoe kan ammoniumcarbonaat van ammoniumbicarbonaat worden gescheiden?
A: Ammoniumcarbonaat kan worden gescheiden van ammoniumwaterstofcarbonaat door het mengsel te verwarmen, omdat ammoniumbicarbonaat wordt afgebroken tot ammoniak, kooldioxide en water, waardoor ammoniumcarbonaat achterblijft.
Vraag: Hoe bereken je de pH van ammoniumbicarbonaat in water?
A: De pH van ammoniumwaterstofcarbonaat in water kan worden berekend met behulp van de Henderson-Hasselbalch-vergelijking: pH = pKa + log([A-]/[HA]), waarbij pKa de zuurdissociatieconstante is en [A-]/[ HA] vertegenwoordigt de verhouding van de geconjugeerde base tot het zuur.
Vraag: Hoe pas ik de pH van ammoniumbicarbonaatbuffer aan?
A: De pH van een ammoniumwaterstofcarbonaatbuffer kan worden aangepast door een sterk zuur toe te voegen om de pH te verlagen of een sterke base om de pH te verhogen, terwijl de juiste verhouding ammoniumbicarbonaat tot zijn geconjugeerde base wordt gehandhaafd.
Vraag: Is ammoniumbicarbonaat veilig in voedsel?
A: Ammoniumwaterstofcarbonaat wordt algemeen erkend als veilig (GRAS) voor gebruik in voedingsmiddelen, maar het moet worden gebruikt volgens de wettelijke richtlijnen en in de juiste hoeveelheden.
Vraag: Wat is een ammoniumbicarbonaatbuffer?
A: Ammoniumwaterstofcarbonaatbuffer is een oplossing die ammoniumwaterstofcarbonaat en de geconjugeerde base (of zuur) ervan bevat en wordt gebruikt om een stabiele pH te handhaven in verschillende biochemische en biologische toepassingen.
Vraag: Wat is de molecuulmassa van ammoniumbicarbonaat?
A: De molecuulmassa van ammoniumwaterstofcarbonaat is ongeveer 79,06 g/mol.
Vraag: Wat is de massapercentage-samenstelling van waterstof in NH4HCO3?
A: De massapercentage-samenstelling van waterstof in NH4HCO3 is ongeveer 6,57%.
Vraag: Is NH4HCO3 een zuur of een base?
A: NH4HCO3 kan zowel als zuur als als base werken, afhankelijk van de context. Het kan een proton (H+) afstaan om als zuur te fungeren, of een proton accepteren om als base te fungeren.
Vraag: Wat is de naam van de verbinding met de formule NH4HCO3?
A: De verbinding met de formule NH4HCO3 wordt ammoniumwaterstofcarbonaat genoemd.
Vraag: Is NH4HCO3 ionisch of covalent?
A: NH4HCO3 wordt beschouwd als een ionische verbinding vanwege de aanwezigheid van het ammoniumion (NH4+) en het waterstofcarbonaation (HCO3-) in de structuur.
