Ammoniumacetaat is een verbinding die in verschillende industrieën wordt gebruikt. Het fungeert als een bron van acetaationen en speelt een rol bij chemische reacties en organische synthese.
| IUPAC-naam | Ammoniumacetaat |
| Moleculaire formule | C2H7NO2 |
| CAS-nummer | 631-61-8 |
| Synoniemen | Ammoniumzout van azijnzuur, ammoniumethanoaat, ammoniumazijnzuur, azijnzuur, ammoniumzout |
| InChi | InChI=1S/C2H4O2.H3N/c1-2(3)4;/h1H3,(H,3,4);1H3 |
Eigenschappen van ammoniumacetaat
Ammoniumacetaatformule
De formule voor het ammoniumzout van azijnzuur is C2H7NO2. Het bestaat uit twee koolstofatomen, zeven waterstofatomen, één stikstofatoom en twee zuurstofatomen.
Ammoniumacetaat molaire massa
De molaire massa van het ammoniumzout van azijnzuur wordt berekend door de atoommassa’s van de samenstellende elementen op te tellen. Dit is ongeveer 77,0825 gram per mol.
Kookpunt van ammoniumacetaat
Het ammoniumzout van azijnzuur heeft een kookpunt van ongeveer 117 graden Celsius. Bij deze temperatuur ondergaat de verbinding een faseverandering van vloeistof naar gas.
Ammoniumacetaat Smeltpunt
Het smeltpunt van het ammoniumzout van azijnzuur is ongeveer 114 graden Celsius. Dit is de temperatuur waarbij de vaste verbinding overgaat in de vloeibare toestand.
Dichtheid van ammoniumacetaat g/ml
De dichtheid van het ammoniumzout van azijnzuur is ongeveer 1,17 gram per milliliter. Het is een maat voor de massa per volume-eenheid van de verbinding.
Ammoniumacetaat Molecuulgewicht
Het molecuulgewicht van het ammoniumzout van azijnzuur is ongeveer 77,0825 gram per mol. Het is de som van de atoomgewichten van alle atomen die in de verbinding aanwezig zijn.
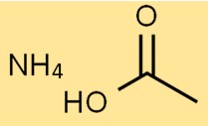
Structuur van ammoniumacetaat
De structuur van het ammoniumzout van azijnzuur bestaat uit één NH4+-ion en één CH3COO-ion. Het NH4+-ion is positief geladen, terwijl het CH3COO-ion negatief geladen is.
Oplosbaarheid van ammoniumacetaat
Het ammoniumzout van azijnzuur is zeer oplosbaar in water. Het lost gemakkelijk op in water en vormt een heldere, kleurloze oplossing. De oplosbaarheid van het ammoniumzout van azijnzuur in water is te danken aan het vermogen ervan om waterstofbruggen te vormen met watermoleculen.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 1,17 g/ml |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 77,0825 g/mol |
| Dikte | 1,17 g/ml |
| Fusie punt | 114°C |
| Kookpunt | 117°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | zeer oplosbaar in water |
| Oplosbaarheid | Oplosbaar in water, azijnzuur, ethanol |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | 4,75 |
| pH | Ongeveer 6,0-7,0 |
Veiligheid en gevaren van ammoniumacetaat
Het ammoniumzout van azijnzuur brengt bij correcte omgang minimale veiligheidsrisico’s met zich mee. Het gebruik ervan wordt over het algemeen als veilig beschouwd in verschillende toepassingen. Zoals bij elke chemische stof moeten er echter voorzorgsmaatregelen worden genomen. Vermijd inademing van stof of dampen, omdat dit irritatie van de luchtwegen kan veroorzaken. Het is raadzaam om geschikte persoonlijke beschermingsmiddelen te dragen, inclusief handschoenen en een veiligheidsbril, wanneer u werkt met ammoniumzout van azijnzuur. In geval van accidentele inname of contact met de ogen of de huid, spoel met veel water en raadpleeg indien nodig een arts. Bewaar het ammoniumzout van azijnzuur op een koele, droge plaats, uit de buurt van onverenigbare stoffen. Volg de juiste hanterings- en verwijderingsprocedures om de veiligheid te garanderen.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Lage toxiciteit |
| VN-identificatienummers | Niet gereguleerd |
| HS-code | 2915.29.10 |
| Gevarenklasse | Ammoniumzout van azijnzuur is niet geclassificeerd |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Lage toxiciteit |
Methoden voor de synthese van ammoniumacetaat
Er zijn verschillende methoden voor het synthetiseren van het ammoniumzout van azijnzuur. Een gebruikelijke aanpak is om azijnzuur te mengen met een waterige oplossing van ammoniumcarbonaat . De reactie daartussen produceert ammoniumzout en azijnwater. Deze methode vereist het beheersen van de temperatuur en druk tijdens de reactie.
Bij een andere methode voegen scheikundigen onder roeren geleidelijk azijnzuur toe aan een ammoniakoplossing totdat de gewenste pH is bereikt. Dit neutralisatieproces zet azijnzuur om in het ammoniumzout van azijnzuur. Zorgvuldig mengen en pH-controle zijn essentieel tijdens deze reactie.
Gebruik ammoniumhydroxide om het ammoniumzout van azijnzuur te synthetiseren door het te combineren met azijnzuur , wat resulteert in de vorming van het ammoniumzout van azijnzuur en water. Volg de voortgang van deze reactie totdat deze voltooid is.
Meng azijnzuuranhydride met ammoniumhydroxide of ammoniak om het ammoniumzout van azijnzuur te bereiden. De reactie tussen deze reagentia resulteert in de vorming van een ammoniumzout van azijnzuur.
Vergeet niet dat het essentieel is om de synthese van ammoniumzout van azijnzuur uit te voeren in een goed geventileerde ruimte en passende veiligheidsmaatregelen te volgen. Zorg tijdens het hele syntheseproces voor een juiste behandeling en opslag van chemicaliën.
Gebruik van ammoniumacetaat
Ammoniumzout van azijnzuur vindt vanwege zijn veelzijdige eigenschappen verschillende toepassingen in verschillende industrieën. Hier zijn enkele veelvoorkomende toepassingen:
- Het ammoniumzout van azijnzuur buffert oplossingen en zorgt voor een stabiel pH-niveau in chemische en biologische laboratoria.
- Analytische methoden zoals chromatografie en massaspectrometrie gebruiken het ammoniumzout van azijnzuur als reagens voor ionisatie en scheiding van verbindingen.
- De moleculaire biologie gebruikt het ammoniumzout van azijnzuur om DNA te laten neerslaan tijdens zuiveringsprocedures, waardoor verontreinigingen en onzuiverheden worden verwijderd.
- Het ammoniumzout van azijnzuur neemt deel aan veel chemische reacties en fungeert als bron van acetaationen bij organische synthese, veresteringsreacties en katalytische processen.
- In de landbouw dient het ammoniumzout van azijnzuur als stikstofbron in meststoffen, waardoor de groei en ontwikkeling van planten wordt bevorderd.
- De textielindustrie gebruikt het ammoniumzout van azijnzuur om stoffen te verven en te bedrukken, waardoor de kleurechtheid wordt verbeterd door de kleurstoffen aan de stof te fixeren.
- De voedingsindustrie keurt ammoniumzout van azijnzuur goed als voedingsadditief en reguleert de zuurgraad om de pH van verschillende voedingsproducten onder controle te houden.
- Bij chemische analysetechnieken zoals HPLC (high performance liquid chromatography) vergemakkelijkt het ammoniumzout van azijnzuur de scheiding en detectie van verbindingen.
Over het geheel genomen is ammoniumzout van azijnzuur een veelzijdige verbinding met toepassingen variërend van laboratoriumtoepassingen tot de landbouw en de voedingsindustrie. Door zijn unieke eigenschappen is het een belangrijk ingrediënt in diverse processen en producten.
Vragen:
Vraag: Hoeveel waterstofatomen zitten er in een molecuul ammoniumacetaat, NH4C2H3O2?
A: Er zijn vier waterstofatomen in één molecuul ammoniumzout van azijnzuur (NH4C2H3O2).
Vraag: Is ammoniumacetaat oplosbaar?
A: Ja, ammoniumzout van azijnzuur is oplosbaar in water.
Vraag: Wat is de formule voor ammoniumacetaat?
A: De formule voor ammoniumzout van azijnzuur is NH4C2H3O2.
Vraag: Is ammoniumacetaat oplosbaar in water?
A: Ja, ammoniumzout van azijnzuur is oplosbaar in water.
Vraag: Hoe bereid ik 1M ammoniumacetaat?
A: Om 1M ammoniumzout van azijnzuur te bereiden, lost u de juiste hoeveelheid ammoniumacetaat op in water om een concentratie van 1 mol per liter (M) te verkrijgen.
Vraag: Hoeveel mol ionen komen er in totaal vrij als 0,624 mol ammoniumacetaat in water wordt opgelost?
A: Wanneer 0,624 mol ammoniumzout van azijnzuur in water wordt opgelost, komen er in totaal 1,248 mol ionen (NH4+ en C2H3O2-) vrij.
Vraag: Wat is het exacte molecuulgewicht van ammoniumacetaat (NH4OAc)?
A: Het exacte molecuulgewicht van het ammoniumzout van azijnzuur (NH4OAc) is ongeveer 77,0825 gram per mol.
Vraag: Hoe maak je 5M ammoniumacetaat?
A: Om 5M ammoniumzout van azijnzuur te bereiden, lost u de juiste hoeveelheid ammoniumacetaat op in water om een concentratie van 5 mol per liter (M) te bereiken.
Vraag: Wat is de pKa van azijnzuur en pKb van ammoniumhydroxide?
A: De pKa van azijnzuur is ongeveer 4,75 en de pKb van het ammoniumzout van azijnzuur is ongeveer 4,25.
