Wat is ammoniak?
Ammoniak of NH3 is een kleurloos, scherp gas bestaande uit stikstof en waterstof, dat in de industrie veel wordt gebruikt als koelmiddel, reinigingsmiddel en kunstmest.
| IUPAC-naam | Ammoniak |
| Moleculaire formule | NH3 |
| CAS-nummer | 7664-41-7 |
| Synoniemen | Azaan, stikstoftrihydride, Hartshornalcohol |
| InChi | InChI=1S/NH3/c1-2 |
Eigenschappen van ammoniak
Lewisstructuur voor ammoniak
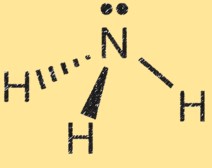
De Lewis-structuur van ammoniak (NH3) toont de rangschikking van elektronen in het molecuul. In een Lewis-structuur vertegenwoordigen punten elektronen en lijnen vertegenwoordigen bindingen tussen atomen.
De Lewis-structuur van ammoniak toont het stikstofatoom omgeven door drie waterstofatomen en een paar elektronen gedeeld tussen de stikstof- en waterstofatomen. Dit vertegenwoordigt de covalente bindingen in het molecuul. Het stikstofatoom heeft vijf valentie-elektronen en de waterstofatomen hebben elk één valentie-elektron. In de Lewis-structuur van ammoniak vormt het stikstofatoom drie enkele bindingen met de waterstofatomen en heeft het één ongedeeld paar elektronen.
Ammoniak formule
De chemische formule voor ammoniak is NH3. De formule geeft aan dat er drie waterstofatomen en één stikstofatoom in elk ammoniakmolecuul zitten. De formule vertegenwoordigt de samenstelling van de stof en biedt belangrijke informatie over de eigenschappen en het gedrag ervan.
NH3 Molaire massa
De molaire massa van een stof is de massa van één mol van de stof en wordt uitgedrukt in gram per mol. De molaire massa van ammoniak (NH3) is 17,0307 g/mol. Dit betekent dat één mol ammoniak een massa heeft van 17,0307 gram. De molmassa van een stof is belangrijk bij het bepalen van het aantal mol in een bepaald monster en kan worden gebruikt om de formulemassa van een verbinding te bepalen.
Kookpunt van ammoniak
NH3 heeft een kookpunt van -33,34°C (-28,012°F). Het kookpunt van een stof is de temperatuur waarbij de dampdruk gelijk is aan de atmosferische druk en deze begint te veranderen van een vloeistof in een gas. Het kookpunt van NH3 is relatief laag in vergelijking met andere chemicaliën, waardoor het een nuttig koelmiddel is in koel- en koelsystemen.
NH3 Smeltpunt
NH3 heeft een smeltpunt van -77,73°C (-107,87°F). Het smeltpunt van een stof is de temperatuur waarbij deze overgaat van vast naar vloeibaar. Het lage smeltpunt van NH3 maakt het een nuttig koelmiddel, omdat het gemakkelijk kan worden gecondenseerd van een gas naar een vloeistof, waardoor het warmte kan absorberen als de toestand verandert.
NH3 Dichtheid g/ml
De dichtheid van een stof is de massa van een monster per volume-eenheid. De dichtheid van NH3 bedraagt 0,769 g/ml. Dit betekent dat één milliliter NH3 een massa heeft van 0,769 gram. De dichtheid van een stof kan worden gebruikt om de hoeveelheid materie in een bepaald volume te bepalen en is een belangrijke eigenschap om te begrijpen hoe een stof zich in verschillende toestanden gedraagt.
NH3 Molecuulgewicht
Het molecuulgewicht van een stof is de som van de atoomgewichten van alle atomen in één molecuul van de stof. Het molecuulgewicht van NH3 (NH3) is 17,0307 g/mol. Dit betekent dat een molecuul NH3 een molecuulgewicht heeft van 17,0307 gram per mol. Het molecuulgewicht van een stof is belangrijk bij het bepalen van het aantal mol in een bepaald monster en kan worden gebruikt om de formulemassa van een verbinding te bepalen.
NH3-structuur
NH3 is een molecuul dat bestaat uit drie waterstofatomen en één stikstofatoom. Het stikstofatoom is via een covalente binding verbonden met de waterstofatomen en het molecuul heeft een trigonale piramidevorm. De bindingshoeken in het molecuul zijn ongeveer 107°. NH3 is een polair molecuul, wat betekent dat het een positief en een negatief uiteinde heeft, en vaak wordt gebruikt als oplosmiddel en reagens bij chemische reacties.
| Verschijning | Kleurloos gas |
| Soortelijk gewicht | 0,59 (lucht = 1) |
| Kleur | Kleurloos |
| Geur | Scherpe en sterke geur |
| Molaire massa | 17,0307 g/mol |
| Dikte | 0,769 g/ml |
| Fusie punt | -77,73°C |
| Kookpunt | -33,34°C |
| Flitspunt | Niet van toepassing (gas) |
| oplosbaarheid in water | Zeer oplosbaar |
| Oplosbaarheid | Oplosbaar in water en de meeste organische oplosmiddelen |
| Dampdruk | 50,7 kPa bij 20°C |
| Dampdichtheid | 0,59 (lucht = 1) |
| pKa | 4,75 |
| pH | 11,6 (verzadigde oplossing) |
Ammoniakveiligheid en gevaren
NH3 is een zeer giftig en corrosief gas dat, als er niet op de juiste manier mee wordt omgegaan, de menselijke gezondheid en het milieu ernstig kan schaden. NH3 kan ernstige brandwonden aan de ogen, huid en luchtwegen veroorzaken en kan bij inademing in hoge concentraties ook dodelijk zijn. Bovendien is NH3 zeer reactief en kan het ontbranden of exploderen als het in contact komt met bepaalde chemicaliën of materialen.
Het is belangrijk om veiligheidsmaatregelen te nemen bij het hanteren of werken met NH3. Dit omvat het dragen van beschermende kleding, zoals handschoenen, een veiligheidsbril en een gezichtsmasker, en het zorgen voor voldoende ventilatie om inademing van het gas te voorkomen. Het is ook belangrijk om NH3 op te slaan in goed geventileerde ruimtes, uit de buurt van warmtebronnen en andere brandbare materialen. Bij blootstelling aan NH3 is het belangrijk om verontreinigde kleding uit te trekken en het getroffen gebied met veel water af te spoelen. Zoek onmiddellijk medische hulp als er symptomen van blootstelling optreden.
| Gevarensymbolen | T+, N |
| Beveiligingsbeschrijving | Milieugevaarlijk, schadelijk bij inademing, irriterend |
| AN-identificaties | VN 1005 |
| HS-code | 2814,1 |
| Gevarenklasse | 2.3 |
| Verpakkingsgroep | II |
| Toxiciteit | Zeer giftige en fatale dosis (inhalatie) – 33-66 ppm |
Methoden voor ammoniaksynthese
Er zijn verschillende methoden voor het synthetiseren van ammoniak, waaronder het Haber-proces, het Ostwald-proces en het Birkeland-Eyde-proces.
Het Haber-proces, ook bekend als het Haber-Bosch-proces, is de meest gebruikte methode voor de industriële synthese van ammoniak. Bij dit proces reageert stikstofgas uit de lucht via een ijzeren katalysator met waterstofgas, waarbij ammoniak ontstaat. De reactie vindt plaats onder hoge druk (ongeveer 150 atmosfeer) en bij een temperatuur van 450-500°C. Het Haber-proces is zeer efficiënt, produceert grote hoeveelheden ammoniak met een hoge opbrengst en wordt gebruikt als de belangrijkste bron van ammoniak voor de productie van kunstmest en andere chemicaliën.
Het Ostwald-proces, ook bekend als het stikstoffixatieproces, is een oudere methode voor de ammoniaksynthese waarbij stikstofgas wordt geoxideerd tot stikstofmonoxide, gevolgd door de reactie van stikstofoxide met meer stikstofgas om ammoniak te vormen. Dit proces is minder efficiënt en is grotendeels vervangen door het Haber-proces.
Het Birkeland-Eyde-proces, ook bekend als het plasmaproces, is een nieuwere methode voor ammoniaksynthese waarbij gebruik wordt gemaakt van een plasma-ontlading om stikstof- en waterstofgassen te dissociëren en ammoniak te vormen. Dit proces bevindt zich nog in de ontwikkelingsfase en is nog niet algemeen aanvaard voor industrieel gebruik.
Samenvattend is het Haber-proces de meest gebruikte methode voor de synthese van ammoniak, terwijl het Ostwald-proces en het Birkeland-Eyde-proces oudere of minder algemeen gebruikte methoden zijn.
Gebruik van ammoniak
Ammoniak is een veelzijdige chemische stof met een breed scala aan toepassingen in de industrie en de landbouw. Enkele van de belangrijkste toepassingen van ammoniak zijn:
- Meststofproductie: Ammoniak, het belangrijkste ingrediënt bij de productie van stikstofmeststoffen, verhoogt de gewasopbrengsten en verbetert de bodemvruchtbaarheid.
- Koeling: Industriële en huishoudelijke koelsystemen gebruiken ammoniak als koelmiddel, inclusief koelkasten en diepvriezers.
- Reiniging: Huishoudelijke schoonmaakmiddelen bevatten vaak ammoniak vanwege het vermogen om vet en vuil op te lossen.
- Farmaceutica: Bij de productie van diverse farmaceutische producten, zoals maagzuurremmers en hoestsiropen, wordt ammoniak als grondstof gebruikt.
- Textielproductie: Bij het verven en bedrukken van textiel, evenals bij de productie van synthetische vezels, wordt ammoniak gebruikt.
- Afvalverwerking: Afvalwaterzuivering en geurbestrijding van rioolwaterzuiveringsinstallaties maken gebruik van ammoniak.
- Vlamvertragers: Ammoniak werkt als vlamvertrager bij de productie van materialen zoals kunststoffen, rubbers en andere.
- Olie- en gasproductie: De olie- en gasindustrie gebruikt ammoniak om verschillende chemicaliën te produceren, waaronder oppervlakteactieve stoffen en demulgatoren.
Kortom, ammoniak is een veelzijdige chemische stof met een breed scala aan toepassingen in verschillende industrieën en toepassingen, waaronder de landbouw, koeling, schoonmaak, farmaceutische industrie, textielproductie, afvalverwerking, vlamvertragers en olie- en gasproductie.
Vragen:
Is ammoniak een zuur of een base?
Ammoniak wordt als een base beschouwd. In waterige oplossingen lost het op om hydroxide-ionen (OH-) te vormen en fungeert het als een zwakke base. Ammoniak heeft een basische (alkalische) pH, meestal rond de 11. Ammoniakoplossingen kunnen zuren neutraliseren om zout en water te vormen, wat een van de bepalende kenmerken van een base is. Bij chemische reacties kan ammoniak ook als nucleofiel werken en deelnemen aan reacties die amiden vormen, dit zijn derivaten van ammoniak en bevatten de stikstof-koolstofbinding die kenmerkend is voor aminen en amiden.
Is ammoniak polair?
Ja, ammoniak is polair. Het heeft een gebogen moleculaire geometrie met een centraal stikstofatoom omgeven door drie waterstofatomen. Deze vorm creëert een permanent dipoolmoment, waarbij het positieve uiteinde van de dipool zich bij de waterstofatomen bevindt en het negatieve uiteinde bij het stikstofatoom. Door de polaire aard van ammoniak kan het oplossen in polaire oplosmiddelen zoals water, wat kenmerkend is voor polaire moleculen. Door de polaire aard van ammoniak kan het ook deelnemen aan waterstofbruggen, een soort intermoleculaire kracht die optreedt tussen polaire moleculen. Deze waterstofbinding kan leiden tot hogere kook- en smeltpunten dan niet-polaire moleculen van vergelijkbare grootte.
