Aluminiumchloride of AlCl3 is een chemische verbinding die in verschillende industriële processen wordt gebruikt. Het fungeert als een Lewis-zuur en katalyseert organische synthese- en polymerisatiereacties. Het heeft ook anti-transpirant eigenschappen in producten voor persoonlijke verzorging.
| IUPAC-naam | Aluminiumtrichloride |
| Moleculaire formule | AlCl3 |
| CAS-nummer | 7446-70-0 |
| Synoniemen | Aluminiumtrichloride, aluminium (III) chloride, aluminium (III) chloride, aluminiumchloride, trichlooraluminium |
| InChi | InChI=1S/3ClH.Al/h3*1H;/q;;;+3/p-3 |
Aluminiumchlorideformule
De chemische formule voor aluminiumchloride is AlCl3. Deze formule vertegenwoordigt het aantal atomen van elk element in het molecuul. De formule voor aluminiumchloride is belangrijk omdat deze wordt gebruikt om de stof te identificeren en de eigenschappen ervan te berekenen. De formule wordt ook gebruikt in chemische vergelijkingen om de reactanten en producten van een chemische reactie weer te geven.
Molaire massa aluminiumchloride
Aluminiumchloride heeft een molaire massa van 133,34 g/mol. Deze waarde wordt berekend door de atoommassa van één aluminiumatoom en drie chlooratomen bij elkaar op te tellen. De molecuulformule voor aluminiumchloride is AlCl3, wat betekent dat het één aluminiumatoom en drie chlooratomen bevat. Molaire massa is een belangrijke eigenschap van aluminiumchloride omdat het in veel chemische reacties en industriële processen wordt gebruikt. Molaire massa wordt ook gebruikt om de hoeveelheid van een stof in een bepaald monster te berekenen.
Kookpunt van aluminiumchloride
Het kookpunt van aluminiumchloride is 180,8°C (357,4°F). Deze waarde is de temperatuur waarbij de vloeibare vorm van aluminiumchloride overgaat in de gasvormige toestand. Het kookpunt van aluminiumchloride is relatief hoog, waardoor het bruikbaar is in veel industriële processen waarbij hoge temperaturen nodig zijn. Aluminiumchloride wordt bijvoorbeeld gebruikt als katalysator bij de vervaardiging van polypropyleen, een thermoplastisch polymeer.
Smeltpunt van aluminiumchloride
Het smeltpunt van aluminiumchloride is 194°C (381,2°F). Deze waarde is de temperatuur waarbij de vaste vorm van aluminiumchloride overgaat in de vloeibare toestand. Het smeltpunt van aluminiumchloride is relatief laag, wat betekent dat het gemakkelijk kan worden gesmolten en gebruikt in verschillende chemische reacties en industriële processen. Aluminiumchloride wordt bijvoorbeeld gebruikt als coagulatiemiddel in de waterbehandelingsindustrie.
Dichtheid van aluminiumchloride g/ml
De dichtheid van aluminiumchloride is 2,44 g/cm3. Deze waarde is de massa aluminiumchloride per volume-eenheid. De dichtheid van aluminiumchloride is belangrijk omdat deze de massa van een bepaald volume van de stof bepaalt. De dichtheid van aluminiumchloride wordt ook gebruikt om de concentratie van de stof in een oplossing te berekenen.
Aluminiumchloridestructuur
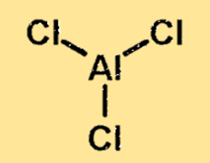
De structuur van aluminiumchloride is een covalent gebonden molecuul met één aluminiumatoom en drie chlooratomen. Het aluminiumatoom bevindt zich in het midden van het molecuul, omringd door de drie chlooratomen. De structuur van aluminiumchloride is belangrijk omdat deze de fysische en chemische eigenschappen van de stof bepaalt.
Molecuulgewicht van aluminiumchloride
Het molecuulgewicht van aluminiumchloride is 133,34 g/mol. Deze waarde is de som van de atoomgewichten van de atomen in het molecuul. Het molecuulgewicht van aluminiumchloride is belangrijk omdat het wordt gebruikt om de hoeveelheid van een stof in een bepaald monster te berekenen. Deze waarde wordt ook gebruikt om de molaire concentratie van een oplossing te bepalen.
| Verschijning | Witte tot gele vaste stof of poeder |
| Soortelijk gewicht | 2,44 g/cm3 |
| Kleur | Kleurloos tot lichtgeel |
| Geur | Geurloos |
| Molaire massa | 133,34 g/mol |
| Dikte | 2,44 g/cm3 |
| Fusie punt | 194°C (381,2°F) |
| Kookpunt | 180,8°C (357,4°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar in water |
| Oplosbaarheid | Oplosbaar in ethanol, methanol en ether |
| Dampdruk | 2,67 kPa bij 25°C |
| Dampdichtheid | 4,45 (lucht = 1) |
| pKa | -6 |
| pH | 2,0 (10 g/l, H2O) |
Veiligheid en gevaren van aluminiumchloride
Aluminiumchloride brengt verschillende veiligheids- en gezondheidsrisico’s met zich mee. Het is bijtend en kan ernstige huid- en oogirritatie veroorzaken, evenals irritatie van de luchtwegen en het spijsverteringskanaal als het wordt ingeslikt of ingeademd. Het kan ook brandwonden veroorzaken als het in contact komt met de huid. Aluminiumchloride is een sterk oxidatiemiddel en kan heftig reageren met water, waarbij waterstofchloridegas vrijkomt. Het is ook onverenigbaar met veel organische verbindingen, zoals alcoholen en aminen, en kan ermee reageren en gevaarlijke gassen produceren. Bij het hanteren van aluminiumchloride moeten geschikte beschermende uitrustingen worden gedragen, waaronder handschoenen, een veiligheidsbril en een gasmasker.
| Gevarensymbolen | Bijtend, schadelijk |
| Beveiligingsbeschrijving | Vermijd contact met huid en ogen. Draag beschermende handschoenen en oog-/gezichtsbescherming. Bij contact met veel water afspoelen en een arts raadplegen. Niet inslikken of inhaleren. Gebruik in een goed geventileerde ruimte. Op een koele, droge plaats bewaren, uit de buurt van onverenigbare materialen. |
| VN-identificatienummers | VN 1726 |
| HS-code | 2827.32.00 |
| Gevarenklasse | 8 |
| Verpakkingsgroep | III |
| Toxiciteit | Giftig bij inslikken of inademen. Veroorzaakt ernstige huid- en oogirritatie. Kan irritatie van de luchtwegen en het spijsverteringskanaal veroorzaken. Kan heftig reageren met water, waarbij waterstofchloridegas vrijkomt. Onverenigbaar met veel organische verbindingen, zoals alcoholen en aminen, en kan ermee reageren en gevaarlijke gassen produceren. |
Methoden voor de synthese van aluminiumchloride
Aluminiumchloride kan op verschillende manieren worden gesynthetiseerd, zoals directe synthese, hydrolyse en reactie van aluminium met waterstofchloride.
- Directe synthese omvat de reactie van aluminium met chloorgas bij hoge temperaturen, gewoonlijk rond de 700-800°C. Door de reactie van aluminium met waterstofchloride ontstaat aluminiumchloride in de gasfase, dat in vloeibare vorm kan worden gecondenseerd.
- Hydrolyse omvat de reactie van metallisch aluminium met zoutzuur of water, waarbij waterstofgas en aluminiumchloride ontstaan. De hydrolysereactie is over het algemeen exotherm en kan gevaarlijk zijn als deze niet correct wordt uitgevoerd.
- Reactie van aluminium met waterstofchloridegas is een andere methode om aluminiumchloride te synthetiseren. Deze reactie vindt plaats bij kamertemperatuur en produceert waterstofgas en aluminiumchloride.
- Een andere gebruikelijke methode voor het synthetiseren van aluminiumchloride is het laten reageren van aluminiumoxide met zoutzuur. Deze reactie produceert aluminiumchloride en water als producten.
- Het laten reageren van aluminium met een mengsel van chloorgas en koolmonoxide is een andere methode om aluminiumchloride te synthetiseren. Deze reactie vindt plaats bij hoge temperaturen en produceert aluminiumchloride en kooldioxide.
Over het geheel genomen vereist de synthese van aluminiumchloride een zorgvuldige omgang en controle van de reactieomstandigheden om een veilig en efficiënt proces te garanderen.
Gebruik van aluminiumchloride
Aluminiumchloride heeft vanwege zijn unieke eigenschappen vele toepassingen in verschillende industrieën.
- Bij organische chemische reacties, waaronder de productie van polymeren, farmaceutische producten en parfums, wordt gewoonlijk aluminiumchloride als katalysator gebruikt.
- Bij de behandeling van drinkwater en afvalwater om zwevende deeltjes te verwijderen wordt vaak aluminiumchloride als coagulatiemiddel gebruikt.
- De productie van aluminium en legeringen profiteert van het gebruik van aluminiumchloride als vloeimiddel, dat helpt onzuiverheden te verwijderen en het gietproces te verbeteren.
- In de petrochemische industrie dient aluminiumchloride als katalysator bij de productie van benzine en andere koolwaterstoffen. Bovendien wordt het gebruikt als deodorant en anti-transpirant in producten voor persoonlijke verzorging.
- Sommige vrij verkrijgbare medicijnen gebruiken aluminiumchloride, dat samentrekkende eigenschappen heeft, om kleine huidirritaties te behandelen en het bloeden te stoppen. Aluminiumchloride wordt ook gebruikt voor de behandeling van hyperhidrose, een aandoening die wordt gekenmerkt door overmatig zweten.
- De textielindustrie gebruikt aluminiumchloride als bijtmiddel om kleurstoffen aan stoffen te helpen hechten, en het wordt ook gebruikt bij de productie van synthetisch rubber.
Over het geheel genomen vindt aluminiumchloride diverse en belangrijke toepassingen in veel industrieën, wat het belang ervan in de moderne wereld onderstreept.
Vragen:
Vraag: Wat vergelijkt 1 mol natriumchloride het beste met 1 mol aluminiumchloride?
A: 1 mol natriumchloride (NaCl) en 1 mol aluminiumchloride (AlCl3) bevatten beide 1 mol chloride-ionen, maar aluminiumchloride bevat drie keer meer kationen dan natriumchloride.
Vraag: Is aluminiumchloride waterig?
A: Aluminiumchloride kan in vaste en waterige vorm voorkomen. Wanneer het in water wordt opgelost, vormt het een zeer zure oplossing als gevolg van hydrolyse van het aluminiumkation.
Vraag: Wat is de juiste formule voor aluminiumchloride?
A: De juiste formule voor aluminiumchloride is AlCl3. Dit geeft aan dat elk aluminiumchloridemolecuul één aluminiumkation (Al3+) en drie chloride-anionen (Cl-) bevat.
Vraag: Is aluminiumchloride veilig?
A: Aluminiumchloride kan gevaarlijk zijn als er niet op de juiste manier mee wordt omgegaan. Het kan huid- en oogirritatie, irritatie van de luchtwegen en het spijsverteringskanaal veroorzaken en kan giftig zijn bij inslikken of inademen. Het moet worden opgeslagen en gehanteerd in een goed geventileerde ruimte en met de juiste beschermende uitrusting.
Vraag: Hoeveel chloride-ionen zitten er in 1,50 mol aluminiumchloride?
A: Omdat de formule voor aluminiumchloride AlCl3 is, bevat elk molecuul drie chloride-ionen. Daarom bevat 1,50 mol aluminiumchloride 1,50 x 3 = 4,50 mol chloride-ionen.
