Het acetaation (C2H3O2-) is een anion bestaande uit één koolstofatoom, twee waterstofatomen en één zuurstofatoom, dat algemeen aanwezig is in de organische chemie en biochemie.
| IUPAC-naam | Ethanoaat |
| Moleculaire formule | C2H3O2- |
| CAS-nummer | 127-09-3 |
| Synoniemen | Azijnzuuranion; Ethaanzuuranion; Acetaat anion |
| InChi | InChI=1S/C2H4O2/c1-2(3)4/h1H3,(H,3,4)/p-1 |
Acetaat vulmiddel
Het acetaation is een anion, wat betekent dat het een negatieve lading heeft. Het acetaation is afgeleid van azijnzuur , een zwak organisch zuur dat in water dissocieert om waterstofionen (H+) en acetaationen (C2H3O2-) te vormen. Het acetaation heeft een lading van -1 en is een veel voorkomend ion in biologische systemen en bij veel chemische reacties.
Acetaat formule
Het acetaation heeft de chemische formule C2H3O2-. Het is een negatief geladen ion bestaande uit twee koolstofatomen, drie waterstofatomen en twee zuurstofatomen. Het acetaation is de geconjugeerde base van azijnzuur , dat de chemische formule CH3COOH heeft. Het acetaation vormt zouten met positief geladen ionen zoals natrium (Na+) en calcium (Ca2+) om respectievelijk natriumacetaat (CH3COO-Na+) en calciumacetaat (CH3COO-Ca2+) te produceren. ).
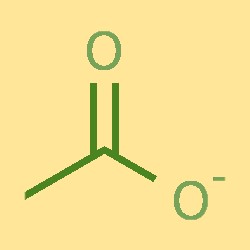
Structuur van acetaationen
Het acetaation bestaat uit één koolstofatoom, twee waterstofatomen en één zuurstofatoom. Het koolstofatoom is gebonden aan één zuurstofatoom en twee waterstofatomen, waardoor een COH-structuur ontstaat. Het zuurstofatoom is ook gebonden aan een negatief geladen ion. Het acetaation heeft een trigonale vlakke vorm, met bindingshoeken van ongeveer 120°.
Acetaat Ion Molaire Massa
De molaire massa van het acetaation (C2H3O2) is 59,04 g/mol. Het wordt berekend door de atoomgewichten van alle atomen in het ion op te tellen. Molaire massa is belangrijk bij het bepalen van de hoeveelheid stof die in een monster aanwezig is.
Kookpunt van acetaationen
Het kookpunt van het acetaation is niet van toepassing omdat het een negatief geladen ion is en niet als een op zichzelf staand molecuul bestaat. Het kookpunt van azijnzuur, dat het acetaation bevat, is echter 118,1°C.
Acetaation Molecuulgewicht
Het molecuulgewicht van het acetaation (C2H3O2) is 59,04 g/mol, wat de som is van de atoomgewichten van alle atomen in het ion. Het molecuulgewicht is nuttig voor het bepalen van de hoeveelheid stof in een monster.
| Verschijning | Niet van toepassing (ion) |
| Soortelijk gewicht | Niet van toepassing (ion) |
| Kleur | Niet van toepassing (ion) |
| Geur | Niet van toepassing (ion) |
| Molaire massa | 59,04 g/mol |
| Dikte | Niet van toepassing (ion) |
| Fusie punt | Niet van toepassing (ion) |
| Kookpunt | Niet van toepassing (ion) |
| Flitspunt | Niet van toepassing (ion) |
| oplosbaarheid in water | Oplosbaar in water |
| Oplosbaarheid | Oplosbaar in water en polaire oplosmiddelen |
| Dampdruk | Niet van toepassing (ion) |
| Dampdichtheid | Niet van toepassing (ion) |
| pKa | 4,76 |
| pH | Zuur |
Veiligheid en gevaren van acetaationen
Het acetaation wordt over het algemeen als veilig beschouwd omdat het een natuurlijk voorkomend ion is in veel voedsel- en drankproducten. Geconcentreerde oplossingen van azijnzuur , die het acetaation bevatten, kunnen echter schadelijk zijn bij inslikken, inademen of bij contact met huid en ogen, waardoor irritatie of chemische brandwonden kunnen ontstaan. Bij het hanteren van geconcentreerde azijnzuuroplossingen moeten geschikte beschermende uitrusting en ventilatie worden gebruikt.
| Gevarensymbolen | Irriterend |
| Beveiligingsbeschrijving | S2 – Buiten bereik van kinderen bewaren. S26 – Bij aanraking met de ogen onmiddellijk met veel water afspoelen en een arts raadplegen. S37 – Draag geschikte handschoenen. S60 – Deze stof en de verpakking ervan moeten als gevaarlijk afval worden afgevoerd. |
| VN-identificatienummers | UN2790 |
| HS-code | 2915.90.90 |
| Gevarenklasse | 8 |
| Verpakkingsgroep | III |
| Toxiciteit | Het acetaation wordt bij inslikken als licht giftig beschouwd, maar geconcentreerde oplossingen van azijnzuur (die acetaationen bevatten) kunnen schadelijk zijn bij inslikken, inademen of bij contact met huid en ogen. |
Methoden voor synthese van acetaationen
De synthese van het acetaation omvat gewoonlijk de vorming van azijnzuur , de moederverbinding die het acetaation bevat. Een gebruikelijke methode voor het synthetiseren van azijnzuur omvat de oxidatie van ethanol met behulp van een oxidatiemiddel zoals chroomzuur. Een andere methode omvat de carbonylering van methanol met behulp van koolmonoxide en een katalysator. Azijnzuur kan ook biologisch worden geproduceerd door de fermentatie van koolhydraten door acetogene bacteriën. Het acetaation kan ook worden verkregen door dissociatie van azijnzuur in een oplossing, waarbij het acetaation en de waterstofionen vrijkomen. In sommige gevallen kan het acetaation ook worden verkregen door de reactie van een azijnzuurester met een sterke base.
Gebruik van acetaationen
Het acetaation (C2H3O2), in de vorm van azijnzuur , dient verschillende doeleinden in alle industrieën. De voedingsindustrie gebruikt azijnzuur als smaakmaker en conserveermiddel vanwege de zure smaak en antimicrobiële eigenschappen. De textielindustrie gebruikt azijnzuur als bestanddeel van wasverzachters en als kleurfixeermiddel. In de chemische industrie dient azijnzuur als grondstof voor de productie van andere chemicaliën, zoals vinylacetaat, dat wordt gebruikt in lijmen en coatings. De farmaceutische industrie gebruikt acetaationen als ingrediënt in medicijnen en als buffer bij medische behandelingen. Bovendien wordt celluloseacetaat, een soort plastic, geproduceerd uit azijnzuur en vindt het toepassing in films en optische vezels.
