Acetamide is een witte kristallijne vaste stof met een lichte geur. Het wordt gesynthetiseerd door azijnzuur te laten reageren met ammoniak. Het wordt vaak gebruikt bij de productie van kunststoffen en farmaceutische producten.
| IUPAC-naam | Ethanamide |
| Moleculaire formule | C2H5NO |
| CAS-nummer | 60-35-5 |
| Synoniemen | Azijnzuuramide, ethamide, ethanamide, CH3CONH2 |
| InChi | InChI=1S/C2H5NO/c1-2(3)4/h1H3,(H2,3,4) |
Eigenschappen van acetamide
Acetamide Molaire Massa
Acetamide heeft een molmassa van 59,07 g/mol, wat de som is van de atoommassa’s van alle atomen in een acetamidemolecuul. De molaire massa van een verbinding is nuttig bij het bepalen van het aantal mol van de verbinding dat in een bepaald monster aanwezig is. Het wordt ook gebruikt om de massapercentagesamenstelling van de verbinding te berekenen.
Kookpunt van aceetamide
Het kookpunt van ethaanamide is 222°C. Dit is de temperatuur waarbij ethaanamide verandert van een vloeistof in een gas. Het kookpunt van een stof wordt beïnvloed door de sterkte van zijn intermoleculaire krachten, en ethanamide heeft sterke waterstofbruggen tussen zijn moleculen. Daarom heeft het een relatief hoog kookpunt in vergelijking met andere amiden.
Smeltpunt van acetamide
Het smeltpunt van ethaanamide is 82,5°C. Dit is de temperatuur waarbij ethanamide verandert van vast naar vloeibaar. Het smeltpunt van een stof wordt beïnvloed door de sterkte van zijn intermoleculaire krachten, en in het geval van ethanamide zijn er sterke waterstofbruggen tussen de moleculen. Daarom is het smeltpunt relatief hoog in vergelijking met andere amiden.
Aceetamide Dichtheid g/ml
De dichtheid van ethanamide is 1,16 g/ml. Dichtheid is de massa van een stof per volume-eenheid en is een nuttige fysieke eigenschap voor het identificeren en karakteriseren van stoffen. Aceetamide is een relatief dichte verbinding en de dichtheid ervan kan worden gebruikt in berekeningen voor verschillende toepassingen.
Aceetamide Molecuulgewicht
Het molecuulgewicht van aceetamide is 59,07 g/mol. Deze waarde is nuttig voor het bepalen van de hoeveelheid aceetamide die in een monster aanwezig is, maar ook voor stoichiometrische berekeningen bij chemische reacties.
Structuur van aceetamide
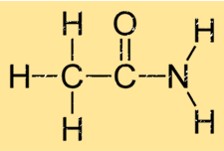
Acetamide heeft een eenvoudige structuur bestaande uit een carbonylgroep (C=O) bevestigd aan een aminogroep (NH2). Dit geeft het de molecuulformule C2H5NO. De carbonyl- en aminogroepen zijn verbonden door een enkel koolstofatoom. Door de structuur van ethanamide kan het sterke waterstofbruggen vormen met andere ethanamidemoleculen, wat bijdraagt aan de fysieke eigenschappen ervan, zoals kookpunt en smeltpunt.
Aceetamide-formule
De chemische formule voor ethanamide is CH3CONH2, wat aangeeft dat het één koolstofatoom, twee waterstofatomen, één stikstofatoom en één zuurstofatoom bevat. De formule is nuttig bij het identificeren van de elementen en hun verhoudingen die in de verbinding aanwezig zijn. Het is ook nuttig voor het bepalen van de stoichiometrie van chemische reacties waarbij ethaanamide betrokken is.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 1,16 g/ml |
| Kleur | Kleurloos |
| Geur | Lichte geur |
| Molaire massa | 59,07 g/mol |
| Dikte | 1,16 g/ml |
| Fusie punt | 82,5°C |
| Kookpunt | 222°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Volledig mengbaar |
| Oplosbaarheid | Oplosbaar in ethanol, ether, benzeen en chloroform |
| Dampdruk | 0,000138 mmHg bij 25°C |
| Dampdichtheid | 2.1 |
| pKa | 16.5 |
| pH | 6,5 – 7,5 (10% waterige oplossing) |
Acetamideveiligheid en gevaren
Acetamide wordt als een relatief veilige verbinding beschouwd, maar kan nog steeds enkele gevaren met zich meebrengen. Het kan bij langdurige blootstelling irritatie van de huid, ogen en luchtwegen veroorzaken. Het kan bij inslikken ook gastro-intestinale irritatie en depressie van het centrale zenuwstelsel veroorzaken. Acetamide is brandbaar en kan brand veroorzaken als het wordt blootgesteld aan hitte of vlammen. Het is belangrijk om voorzichtig om te gaan met ethanamide en beschermende uitrusting te gebruiken, zoals handschoenen en een veiligheidsbril, wanneer u ermee werkt. Adequate ventilatie en opslag zijn ook noodzakelijk om onnodige blootstelling te voorkomen en potentiële risico’s te minimaliseren.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Vermijd langdurige blootstelling. Draag beschermende uitrusting. Voldoende ventilatie en opslag zijn noodzakelijk. |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | 29242990 |
| Gevarenklasse | Niet geclassificeerd als gevaarlijk door OSHA of GHS |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | LD50 (oraal, rat): 3,8 g/kg; LC50 (inhalatie, rat): >20 mg/L (blootstelling van 4 uur) |
Acetamidesynthesemethoden
Ammoniak- of ammoniumzouten kunnen reageren met azijnzuur om ethanamide te synthetiseren, ammoniak kan reageren met acetylchloride om ethanamide te synthetiseren, en ammoniumacetaat kan uitdroging ondergaan om ethanamide te synthetiseren.
Bij de eerste methode katalyseert zinkoxide of koper de reactie van azijnzuur en ammoniak- of ammoniumzouten om ethanamide te synthetiseren. De reactie produceert ethanamide en water als bijproducten.
Bij de tweede methode reageert een base zoals natriumhydroxide of ammoniakgas met acetylchloride om ethanamide te produceren. De reactie produceert ethanamide en waterstofchloridegas als bijproducten.
Bij de derde methode vergemakkelijkt een dehydraterend middel zoals zwavelzuur de dehydratatie van ammoniumacetaat om ethanamide en water als bijproduct te synthetiseren.
Gebruik van acetamide
Acetamide heeft veel toepassingen in verschillende industrieën vanwege zijn unieke eigenschappen. Enkele veel voorkomende toepassingen van ethaanamide zijn:
- Oplosmiddel: Fabrikanten gebruiken het vaak als oplosmiddel om kunststoffen, vezels en harsen te produceren.
- Farmaceutische industrie: Gebruikt in de farmaceutische industrie als grondstof voor de synthese van verschillende medicijnen en ook als stabilisator voor bepaalde antibiotica.
- Textielindustrie: Gebruikt in de textielindustrie als weekmaker voor synthetische vezels zoals nylon en als kleurmiddel voor katoen en andere natuurlijke vezels.
- Chemische industrie: Wordt ook gebruikt als chemisch tussenproduct bij de productie van verschillende chemicaliën zoals acrylonitril, azijnzuuranhydride en acrylamide.
- Voedingsindustrie: gebruikt als smaakstof en ingrediënt in sommige voedingsproducten zoals gebak, snoep en ijs.
- Laboratoriumonderzoek: Gebruikt in laboratoriumonderzoek als oplosmiddel, reagens en ook als denatureringsmiddel voor eiwitten.
Vragen:
Vraag: Welk reagens of welke reeks reagentia zal acetamide in ethylacetaat omzetten?
A: Acetamide kan worden omgezet in ethylacetaat door het te laten reageren met ethylchloorformiaat in aanwezigheid van een base zoals pyridine. De reactie produceert ethylacetaat, kooldioxide en waterstofchloridegas als bijproducten.
Vraag: Is acetamide een aminozuur?
A: Nee, ethanamide is geen aminozuur. Het is een derivaat van azijnzuur en bevat een amide-functionele groep (-CONH2) in plaats van een aminogroep (-NH2).
Vraag: Wat is het product van de reactie van acetamide met HO-?
A: De reactie van aceetamide met HO- (hydroxide-ion) resulteert in de hydrolyse van acetamide om azijnzuur en ammoniak te vormen.
Vraag: Hoe verwijder ik aceetamide-oplosmiddel uit kristallen?
A: Om het ethanamide-oplosmiddel uit kristallen te verwijderen, kunnen technieken zoals herkristallisatie of vacuümfiltratie worden gebruikt. Herkristallisatie omvat het oplossen van de kristallen in een geschikt oplosmiddel, zoals water, en het vervolgens langzaam laten verdampen van het oplosmiddel om zuivere kristallen te verkrijgen. Vacuümfiltratie omvat het filteren van de kristallen door filtreerpapier onder verminderde druk om eventueel achtergebleven ethaanamide-oplosmiddel te verwijderen.
Vraag: Heeft aceetamide een waterstofbrug?
A: Ja, ethanamide kan deelnemen aan waterstofbruggen vanwege de aanwezigheid van een waterstofbrugacceptor (-CO) en een waterstofbrugdonor (-NH2) in zijn moleculaire structuur.
