Aceetaldehyde is een vluchtige organische stof die wordt geproduceerd tijdens het metabolisme van alcohol en katersymptomen veroorzaakt. Het wordt ook gebruikt als chemisch tussenproduct in verschillende industrieën.
| IUPAC-naam | Ethanal |
| Moleculaire formule | C₂H₄O |
| CAS-nummer | 75-07-0 |
| Synoniemen | Ethylaldehyde, azijnaldehyde, ethanal, 1-oxapropyleen |
| InChi | InChI=1S/C2H4O/c1-2-3/h2H,1H3 |
Eigenschappen van aceetaldehyde
Aceetaldehyde-formule
De formule voor ethanal is C₂H₄O. Het bestaat uit twee koolstofatomen, vier waterstofatomen en één zuurstofatoom. De formule vertegenwoordigt de verhouding van atomen die aanwezig zijn in een ethanalmolecuul.
Aceetaldehyde molaire massa
De molaire massa van ethanol is ongeveer 44,05 g/mol. Het wordt berekend door de atoommassa’s van alle atomen in het molecuul op te tellen volgens de formule C₂H₄O.
Kookpunt van aceetaldehyde
Ethanal heeft een kookpunt van ongeveer 20,2 graden Celsius (68,4 graden Fahrenheit). Dit is de temperatuur waarbij ethanol onder standaard atmosferische druk van vloeistof naar gas verandert.
Aceetaldehyde Smeltpunt
Het smeltpunt van ethanol is ongeveer -123,5 graden Celsius (-190,3 graden Fahrenheit). Dit is de temperatuur waarbij ethanol overgaat van vaste naar vloeibare toestand.
Aceetaldehyde Dichtheid g/ml
De dichtheid van ethanol is ongeveer 0,78 g/ml. Deze waarde vertegenwoordigt de massa ethanol per volume-eenheid. Het geeft aan hoe dicht moleculen in een bepaald volume van de stof zijn verpakt.
Aceetaldehyde Molecuulgewicht
Het molecuulgewicht van ethanol is ongeveer 44,05 g/mol. Het is de som van de atoomgewichten van alle atomen in het molecuul en wordt uitgedrukt in gram per mol.
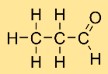
Structuur van aceetaldehyde
Ethanal heeft een lineaire structuur, waarbij koolstofatomen aan elkaar en aan het zuurstofatoom gebonden zijn. Het molecuul heeft een centraal koolstofatoom, twee waterstofatomen eraan vastgemaakt en een zuurstofatoom gebonden aan het koolstofatoom.
Oplosbaarheid van acetaldehyde
Ethanal is oplosbaar in water en organische oplosmiddelen. Het lost gemakkelijk op in water vanwege de aanwezigheid van polaire functionele groepen. De oplosbaarheid van ethanal in water neemt af bij toenemende temperatuur.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 0,780 g/ml |
| Kleur | Kleurloos |
| Geur | Kruidig, fruitig |
| Molaire massa | 44,05 g/mol |
| Dikte | 0,78 g/ml |
| Fusie punt | -123,5°C |
| Kookpunt | 20,2°C |
| Flitspunt | -36°C |
| oplosbaarheid in water | Mengbaar |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen zoals ether, alcohol, azijnzuur |
| Dampdruk | 97,2 mmHg bij 25°C |
| Dampdichtheid | 1,52 (lucht = 1) |
| pKa | 13:55 uur |
| pH | 3,5-4,5 |
Aceetaldehyde Veiligheid en gevaren
Ethanal brengt verschillende veiligheids- en gevaarproblemen met zich mee. Het is licht ontvlambaar, dus er moeten voorzorgsmaatregelen worden genomen om ontstekingsbronnen te vermijden. Inademing van ethanoldampen kan de luchtwegen, ogen en huid irriteren. Langdurige blootstelling kan ernstigere gevolgen voor de gezondheid veroorzaken. Ethanal is ook een potentieel carcinogeen, geassocieerd met een verhoogd risico op kanker. Bij het hanteren van ethanol moeten adequate ventilatie en persoonlijke beschermingsmiddelen worden gebruikt. Bovendien is het belangrijk om ethanal op te slaan en te hanteren in een goed geventileerde ruimte, uit de buurt van onverenigbare stoffen. Naleving van veiligheidsrichtlijnen en -protocollen is van cruciaal belang om de risico’s die aan ethanol zijn verbonden tot een minimum te beperken.
| Gevarensymbolen | Ontvlambaar, schadelijk, kankerverwekkend |
| Beveiligingsbeschrijving | Uit de buurt houden van hitte, vonken en open vuur. Vermijd inademing en contact met ogen en huid. Gebruik voldoende ventilatie en persoonlijke beschermingsmiddelen. Opslaan in een koele, goed geventileerde ruimte, uit de buurt van onverenigbare stoffen. Volg de veiligheidsinstructies en protocollen. |
| VN-identificatienummers | VN1089 |
| HS-code | 29121900 |
| Gevarenklasse | 3 (Ontvlambare vloeistoffen) |
| Verpakkingsgroep | II |
| Toxiciteit | Acute toxiciteit: Schadelijk bij inslikken, inademen of opname via de huid. Langdurige blootstelling kan het risico op kanker vergroten. |
Methoden voor de synthese van aceetaldehyde
Er zijn verschillende methoden voor het synthetiseren van ethanol. Een gebruikelijke aanpak is om ethanol te oxideren met behulp van oxidatiemiddelen zoals kaliumdichromaat of koperoxide onder zure omstandigheden. Deze reactie produceert ethanol als hoofdproduct.
Een andere methode is het dehydrogeneren van ethyleen door het bij hoge temperatuur over een katalysator zoals zilver of koper te leiden. Dit proces verwijdert waterstofatomen uit ethyleen , wat resulteert in de vorming van ethanal.
Bij de hydratatie van acetyleen kan ethanal worden verkregen. Wanneer acetyleengas reageert met water in aanwezigheid van katalysatoren zoals kwiksulfaat of fosforzuur, produceert het ethanal.
Geschikte oxidatiemiddelen zoals salpeterzuur of kaliumpermanganaat kunnen worden gebruikt om ethanal te produceren door ethyleenglycol te oxideren. Deze oxidatie zet ethyleenglycol om in ethanal.
Deze voorbeelden illustreren verschillende methoden voor het synthetiseren van ethanol, elk met zijn eigen voordelen. De keuze van de methode kan afhangen van factoren zoals de beschikbaarheid van grondstoffen, de gewenste opbrengst en de reactieomstandigheden.
Gebruik van acetaldehyde
Ethanal heeft verschillende toepassingen in verschillende industrieën. Hier zijn enkele van de belangrijkste toepassingen:
- Chemisch tussenproduct: Ethanal dient als een belangrijk chemisch tussenproduct bij de productie van veel organische verbindingen, waaronder azijnzuur, pyridine en pentaerythritol.
- Voedings- en drankenindustrie: In de voedingsmiddelen- en drankenindustrie wordt ethanol gebruikt als smaakstof en conserveermiddel. Ethanal geeft fruitige of nootachtige smaken aan verschillende producten, zoals vruchtensappen, snoepjes en gebak.
- Productie van plastic en hars: Fabrikanten gebruiken ethanol om kunststoffen en harsen te produceren, waaronder polyvinylacetaat (PVA) en polyacetaal.
Deze materialen vinden toepassingen in lijmen, coatings en synthetische vezels. - Farmaceutische producten: Ethanal is een voorloper in de synthese van veel farmaceutische verbindingen. Ethanal speelt een rol bij de productie van vitamines, antimalariamiddelen en kalmerende middelen.
- Rubberindustrie: Bij de productie van synthetisch rubber wordt gebruik gemaakt van ethanol. Het vergemakkelijkt de verknoping van rubberpolymeren, waardoor hun duurzaamheid en elasticiteit wordt verbeterd.
- Textielindustrie: Ethanal vindt toepassing als verf- en finishmiddel in de textielindustrie. Het helpt de kleurechtheid en de algehele kwaliteit van textielmaterialen te verbeteren.
- Brandstof en energie: Ethanal is een potentiële kandidaat voor biobrandstoffen vanwege zijn hoge energie-inhoud. Ethanal fermenteert actief tot ethanol of dient actief als brandstofadditief.
Dit zijn slechts enkele voorbeelden van de veelzijdige toepassingen van ethanol. De uiteenlopende eigenschappen maken het tot een waardevol onderdeel in diverse industriële processen en dragen bij aan de ontwikkeling van een breed scala aan producten in meerdere sectoren.
Vragen:
Vraag: Hoe verwijder ik acetaldehyde uit het lichaam?
A: Ethanal wordt op natuurlijke wijze afgebroken door leverenzymen, maar het handhaven van een gezonde levensstijl, inclusief goede hydratatie en een uitgebalanceerd dieet, kan de ontgiftingsprocessen van het lichaam ondersteunen.
Vraag: Wat is aceetaldehyde?
A: Ethanal is een vluchtige organische stof die van nature in het lichaam wordt geproduceerd tijdens het metabolisme van alcohol en ook wordt aangetroffen in verschillende industriële processen en voedingsproducten.
Vraag: Welke atomaire of hybride orbitalen vormen de binding tussen C2 en O in aceetaldehyde, CH3CHO?
A: De binding tussen C2 en O in aceetaldehyde wordt gevormd door de overlap van de sp² hybride orbitaal van koolstof en de sp² hybride orbitaal van zuurstof.
Vraag: Hoe beïnvloedt acetaldehyde de lever?
A: Ethanal kan leverschade veroorzaken door de normale functies ervan te verstoren, wat kan leiden tot ontstekingen, oxidatieve stress en vetophopingen in de lever.
Vraag: Hoe ruikt acetaldehyde?
A: Ethanal heeft een scherpe, fruitige geur, die vaak wordt omschreven als vergelijkbaar met vers gesneden appels of nagellakremover.
Vraag: Is aceetaldehyde oplosbaar in water?
A: Ja, ethanal is oplosbaar in water. Het lost gemakkelijk op vanwege de aanwezigheid van polaire functionele groepen.
Vraag: Moet ik het eten van voedsel dat acetaldehyde bevat vermijden?
A: Ethanal komt van nature voor in veel voedingsmiddelen, waaronder fruit, groenten en gefermenteerde producten. Matige consumptie van deze voedingsmiddelen is over het algemeen veilig voor de meeste mensen.
Vraag: Waar zit aceetaldehyde in?
A: Ethanal kan worden aangetroffen in alcoholische dranken, fruit, groenten, koffie, brood en diverse gefermenteerde voedingsproducten.
Vraag: Hoe smaakt acetaldehyde?
A: Ethanal heeft een scherpe, bittere smaak.
Vraag: Hoe bewaar ik acetaldehyde?
A: Ethanal moet worden bewaard in een koele, goed geventileerde ruimte, uit de buurt van ontstekingsbronnen, onverenigbare stoffen en direct zonlicht. Het wordt meestal opgeslagen in afgesloten containers.
Vraag: Hoe beïnvloedt acetaldehyde het lichaam?
A: Ethanal kan toxische effecten op het lichaam hebben en symptomen veroorzaken zoals hoofdpijn, misselijkheid en blozen, vooral als het in grote hoeveelheden wordt geproduceerd tijdens het metabolisme van alcohol.
Vraag: Waar wordt acetaldehyde voor gebruikt?
A: Ethanal wordt gebruikt als chemisch tussenproduct in verschillende industrieën, waaronder de voedingsmiddelen- en drankenindustrie, de farmaceutische industrie, de kunststoffen- en textielsector.
Vraag: Hoe spreek je aceetaldehyde uit?
A: Uh-zie-tuhl-deh-hahyd.
