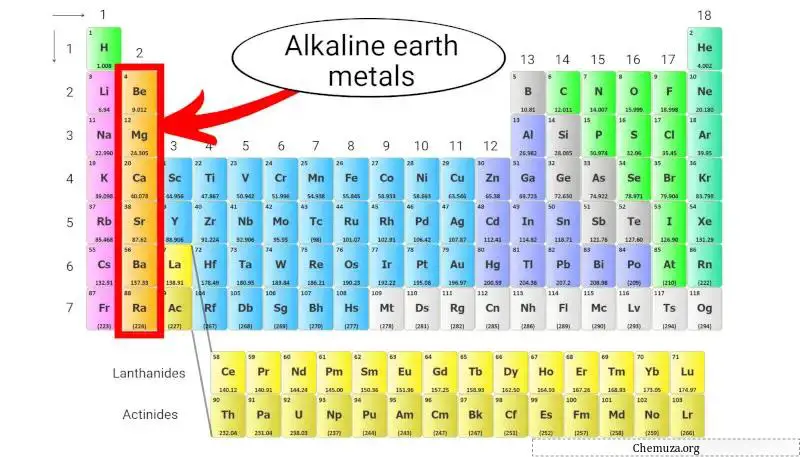
Aardalkalimetalen zijn een groep elementen die zich in de tweede kolom van het periodiek systeem bevinden. Ze omvatten beryllium (Be), magnesium (Mg), calcium (Ca), strontium (Sr), barium (Ba) en radium (Ra).
Deze metalen hebben twee elektronen in hun buitenste schil, [1] waardoor ze chemisch reactief zijn, maar niet zo reactief als de alkalimetalen , die zich in de eerste kolom bevinden.
Laten we meer ontdekken over de aardalkalimetalen in het periodiek systeem.
Wat zijn aardalkalimetalen?

Aardalkalimetalen maken deel uit van groep 2 van het periodiek systeem en hebben twee bijzondere kenmerken.
- Wanneer ze reageren met water, produceren ze hydroxiden die alkalisch of basisch van aard zijn.
- Hun oxidemineralen (BeO, magnesiet, MgO, beryl, enz.) worden voornamelijk in de aardkorst aangetroffen en zijn hittestabiel.
Uitleg
Wanneer aardalkalimetalen (Mg, Ca, Sr, Ba en Ra) reageren met water, vormen ze hydroxiden die alkalisch (of basisch) van aard zijn. [2]
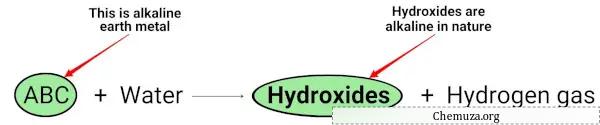
Je kunt in de bovenstaande chemische vergelijking zien dat alkalimetalen hydroxiden geven die basisch van aard zijn (met een pH > 7) en waterstofgas vrijgeven.
Bijvoorbeeld:
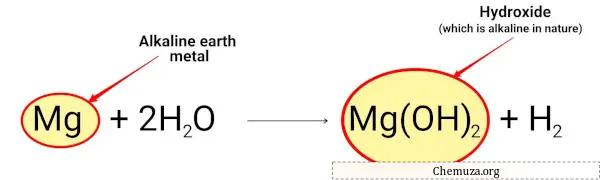
Magnesium reageert met water en vormt magnesiumhydroxide dat alkalisch van aard is.
Bovendien worden deze metalen voornamelijk in de aardkorst aangetroffen (als oxiden) en zijn deze geoxideerde mineralen hittestabiel. [2]
Deze twee criteria geven deze metalen hun naam “aardalkalimetalen”.
(Opmerking: het is belangrijk op te merken dat beryllium, dat ook een element uit Groep 2 is, geen alkalische oplossing vormt wanneer het met water reageert. In plaats daarvan vertonen de hydroxiden amfoteer gedrag, wat betekent dat ze zich kunnen gedragen als een zuur of een base. Daarom wordt beryllium niet als een aardalkalimetaal beschouwd, ook al behoort het tot dezelfde groep.)
Wat hebben alle aardalkalimetalen gemeen?
Aardalkalimetalen hebben een aantal gemeenschappelijke kenmerken.
Ze hebben bijvoorbeeld allebei twee valentie-elektronen in hun buitenste energieniveau, waardoor ze behoorlijk reactief zijn.
Deze reactiviteit is te wijten aan de neiging om deze elektronen te verliezen tijdens chemische reacties, wat resulteert in de vorming van kationen met lading +2.
Bovendien hebben alle aardalkalimetalen een glanzend, zilverwit uiterlijk.

Dat zijn dus de twee belangrijkste dingen die aardalkalimetalen gemeen hebben.
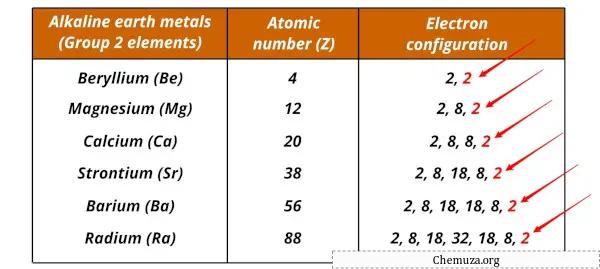
Lijst met alkalimetalen en hun elektronische configuraties
Aardalkalimetalen en hun elektronische configuraties worden hieronder weergegeven.
| Element | Elektronische configuratie |
| Beryllium (Be) | [Hij] 2s 2 |
| Magnesium (Mg) | [Doen] 3s 2 |
| Calcium (Ca) | [Ar] 4s 2 |
| Strontium (Sr) | [Kr] 5s 2 |
| Barium (Ba) | [Xe] 6s 2 |
| Radium (Ra) | [Rn] 7s 2 |
Periodieke trends in aardalkalimetalen
Naarmate men lager in de aardalkalimetaalgroep van het periodiek systeem komt, kunnen de volgende trends worden waargenomen:
- Valentie: Alle aardalkalimetalen hebben dezelfde valentie van +2. Er is dus geen verandering in de valentie als we de groep aflopen.
- Atoomgrootte: De atomaire grootte van aardalkalimetalen neemt toe naarmate men lager in de groep komt. Dit komt omdat het aantal elektronische lagen (of banen ) toeneemt en het afschermende effect van de interne elektronen de aantrekkingskracht tussen de kern en de buitenste elektronen vermindert.
- Metaalachtig karakter: Het metaalachtig karakter van aardalkalimetalen neemt toe naarmate men lager in de groep komt. Dit komt omdat atomen groter worden en meer elektronen bevatten, waardoor ze gemakkelijker elektronen kunnen verliezen en positieve ionen kunnen vormen.
- Elektronegativiteit: De elektronegativiteit van aardalkalimetalen neemt af naarmate men lager in de groep komt. Dit komt omdat atomen groter worden en meer elektronenschillen hebben, waardoor het voor hen moeilijker wordt om elektronen naar zich toe te trekken.
- Elektronische affiniteit: De elektronische affiniteit van aardalkalimetalen is over het algemeen laag en neemt af naarmate men lager in de groep komt.
- Ionisatie-energie: De ionisatie-energie van aardalkalimetalen neemt af naarmate men lager in de groep komt. Dit komt omdat grotere atomen meer elektronenschillen hebben en de buitenste elektronen verder van de kern verwijderd zijn, waardoor ze gemakkelijker te verwijderen zijn.
Samenvatting
Aardalkalimetalen omvatten beryllium, magnesium, calcium, strontium, barium en radium. Ze hebben twee elektronen in hun buitenste schil, waardoor ze reactief zijn, maar minder dan alkalimetalen.
Deze metalen produceren alkalische hydroxiden wanneer ze reageren met water en bevatten hittestabiele geoxideerde mineralen. De belangrijkste kenmerken die alle aardalkalimetalen gemeen hebben, zijn dat ze twee valentie-elektronen hebben, zilverwit en glanzend zijn en kationen vormen met een lading van +2.
De valentie blijft hetzelfde als je naar beneden in de groep gaat, maar de atomaire grootte en het metallische karakter nemen toe, terwijl de elektronegativiteit, elektronenaffiniteit en ionisatie-energie afnemen.
