Lithiumoxide (Li2O) is een verbinding gemaakt van lithium en zuurstof. Het vertoont sterke ionische eigenschappen en wordt veel gebruikt in batterijen vanwege het hoge elektrochemische potentieel.
| IUPAC-naam | Lithiumoxide |
| Moleculaire formule | Li2O |
| CAS-nummer | 12142-77-7 |
| Synoniemen | Lithium(I)oxide; Dilithiumoxide; Lithia; Oxolithium; UNII-06T3K8P3KU |
| InChi | InChI=1S/2Li.O |
Lithiumoxide-formule
Lithiumoxide-formule
De chemische formule voor dilithiumoxide is Li2O. Het vertegenwoordigt de combinatie van twee lithium (Li) atomen en één zuurstofatoom (O). Deze eenvoudige en stabiele verbinding is essentieel in diverse industriële toepassingen.
Molaire massa van lithiumoxide
De molaire massa van Li2O is ongeveer 29,88 g/mol. Het wordt berekend door de atoommassa van twee lithiumatomen (elk 6,94 g/mol) en één zuurstofatoom (16,00 g/mol) op te tellen.
Kookpunt van lithiumoxide
Dilithiumoxide heeft een indrukwekkend kookpunt van ongeveer 2.463 graden Celsius (4.465 graden Fahrenheit). Dit uitzonderlijk hoge kookpunt maakt het nuttig in industrieën die extreme hittebestendigheid vereisen.
Smeltpunt van lithiumoxide
Het smeltpunt van dilithiumoxide is ongeveer 1.450 graden Celsius (2.642 graden Fahrenheit). Bij blootstelling aan deze temperatuur verandert het van een vaste naar een vloeibare toestand, waardoor verschillende productieprocessen worden vergemakkelijkt.
Dichtheid van lithiumoxide g/ml
Dilithiumoxide heeft een dichtheid van ongeveer 2,01 g/ml. Deze waarde vertegenwoordigt de massa van de verbinding per volume-eenheid en is essentieel voor het bepalen van de eigenschappen en toepassingen ervan.
Molecuulgewicht van lithiumoxide
Het molecuulgewicht van Li2O is 29,88 g/mol. Het is de som van de atoomgewichten van de samenstellende elementen, lithium en zuurstof. Deze waarde vergemakkelijkt stoichiometrische berekeningen.
Structuur van lithiumoxide
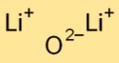
Dilithiumoxide heeft een eenvoudige ionische kristalstructuur. Het bestaat uit lithiumkationen (Li+) en oxide-anionen (O2-) die bij elkaar worden gehouden door sterke elektrostatische krachten. Deze opstelling draagt bij aan de stabiliteit en geleidbaarheid ervan.
Oplosbaarheid van lithiumoxide
Dilithiumoxide heeft een lage oplosbaarheid in water. Het reageert met water om lithiumhydroxide te vormen, waardoor het oplossen ervan wordt beperkt. Het vertoont echter enige oplosbaarheid in sommige niet-waterige oplosmiddelen en gesmolten zouten.
Concluderend is dilithiumoxide een belangrijke verbinding met verschillende kenmerken en toepassingen. De stabiele structuur en de hoge smelt- en kookpunten maken het waardevol in industrieën zoals keramiek, glasproductie en als onderdeel van gespecialiseerde batterijen. Door de eigenschappen ervan te begrijpen, kunnen we het potentieel ervan voor verschillende doeleinden benutten.
| Verschijning | Witte vaste stof |
| Soortelijk gewicht | 2,01 g/ml |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 29,88 g/mol |
| Dikte | 2,01 g/ml |
| Fusie punt | 1.450°C (2.642°F) |
| Kookpunt | 2463°C (4465°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Reageert met water |
| Oplosbaarheid | Slechte wateroplosbaarheid, vorm van lithiumhydroxide |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet toepasbaar |
| pH | Niet toepasbaar |
Houd er rekening mee dat sommige eigenschappen, zoals vlampunt, dampdruk, dampdichtheid, pKa en pH, niet van toepassing of beschikbaar zijn voor Li2O vanwege de chemische aard en het gedrag ervan.
Veiligheid en gevaren van lithiumoxide
Dilithiumoxide brengt bepaalde veiligheidsproblemen en gevaren met zich mee. Het reageert sterk met water, waarbij lithiumhydroxide ontstaat, dat bijtend is en huid- en oogirritatie kan veroorzaken. Inademing van het stof of de dampen ervan kan irritatie van de luchtwegen veroorzaken. De verbinding is niet geclassificeerd als zeer giftig, maar moet met zorg worden gehanteerd om contact met de huid of ogen te vermijden. Goede ventilatie en persoonlijke beschermingsmiddelen zijn essentieel bij het werken met dilithiumoxide. In geval van accidentele inname is onmiddellijke medische hulp noodzakelijk. Bovendien moet het uit de buurt van onverenigbare stoffen worden bewaard om elk potentieel risico op brand of explosie te voorkomen.
| Gevarensymbolen | Bijtend |
| Beveiligingsbeschrijving | Reageert met water. Veroorzaakt huid- en oogirritatie. Breekbaar. Vermijd inademing van stof of dampen. |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | 2825.70.00 |
| Gevarenklasse | 8 (Bijtende stoffen) |
| Verpakkingsgroep | III |
| Toxiciteit | Niet erg giftig, maar voorzichtigheid is geboden. Vermijd inslikken en contact met de huid of ogen. |
Synthesemethoden voor lithiumoxide
Verschillende methoden maken de synthese van dilithiumoxide mogelijk.
Een gebruikelijke aanpak is het laten reageren van lithiummetaal met zuurstof of lucht bij hoge temperaturen. Bij dit proces vergemakkelijkt zuurstofgas de verwarming van lithiummetaal, wat resulteert in de vorming van dilithiumoxide.
Een andere methode is de thermische ontleding van lithiumzouten, zoals lithiumcarbonaat of lithiumhydroxide , bij verhoogde temperaturen. Door deze zouten aan hitte te onderwerpen, vallen ze uiteen en produceren ze dilithiumoxide.
Om dilithiumoxide te produceren, kan bovendien lithiumhydroxide als precursor worden gebruikt. Het wordt eerst gedehydrateerd door verhitting, waardoor het in de gewenste oxidevorm wordt omgezet.
Een andere techniek omvat het gebruik van mineralen of ertsen die lithium bevatten. Chemische processen extraheren lithiumverbindingen uit deze natuurlijke bronnen, die op hun beurt verdere verwerking ondergaan om dilithiumoxide te produceren.
Het is essentieel op te merken dat elke synthesemethode specifieke voordelen en uitdagingen kan hebben in termen van kosten, efficiëntie en zuiverheid. Wetenschappers en ingenieurs houden rekening met deze factoren bij het selecteren van de meest geschikte methode voor de productie van dilithiumoxide om aan specifieke industriële of onderzoeksvereisten te voldoen.
Gebruik van lithiumoxide
Dilithiumoxide (Li2O) vindt vanwege zijn unieke eigenschappen veelzijdige toepassingen in verschillende industrieën. Hier zijn enkele belangrijke toepassingen:
- Keramische industrie: Dilithiumoxide is een cruciaal onderdeel van keramiek en verbetert de mechanische sterkte en thermische stabiliteit ervan. Het verlaagt ook de kooktemperatuur, waardoor energie wordt bespaard tijdens het productieproces.
- Glasproductie: In de glasindustrie werkt dilithiumoxide als een vloeimiddel, waardoor de smelttemperatuur van glas wordt verlaagd en de weerstand tegen chemische aantasting wordt verbeterd, wat resulteert in hoogwaardige glasproducten.
- Batterijtechnologie: Dilithiumoxide dient als voorloper bij de productie van lithium-ionbatterijen. Het draagt bij aan de kathodematerialen van de batterij, waardoor de energieopslagcapaciteit en de algehele prestaties worden verbeterd.
- Droogmiddel: De sterke affiniteit van dilithiumoxide voor water maakt het tot een effectief droogmiddel dat wordt gebruikt om vocht uit bepaalde omgevingen te verwijderen, zoals in airconditioning- en gaszuiveringssystemen.
- Metallurgie: Bij metallurgische processen helpt dilithiumoxide bij de raffinage van metalen door onzuiverheden te verwijderen.
- Speciale brillen: Bij de productie van speciale brillen voor diverse toepassingen, zoals optica, elektronica en wetenschappelijke instrumenten, wordt gebruik gemaakt van dilithiumoxide.
- Katalysator: Dilithiumoxide dient als katalysator bij bepaalde chemische reacties en vergemakkelijkt de transformatie van reactanten in gewenste producten.
- Nucleaire industrie: In de nucleaire industrie functioneert dilithiumoxide als een neutronenmoderator, die de snelheid van kernsplijtingsreacties controleert.
De diversiteit aan toepassingen onderstreept het belang van dilithiumoxide voor de vooruitgang van technologie, productie en wetenschappelijk onderzoek. De unieke eigenschappen ervan blijven innovatie in verschillende industrieën stimuleren, waardoor het een waardevolle verbinding is met een breed scala aan praktische toepassingen.
Vragen:
Vraag: Uit welke vergelijking blijkt dat lithiumoxide wordt gevormd door de reactie tussen zuurstof en lithium?
A: 4Li + O2 → 2Li2O
Vraag: Wat is de molaire massa van lithiumoxide, Li2O?
A: De molaire massa van Li2O is ongeveer 29,88 g/mol.
Vraag: Wat is de formule voor lithiumoxide?
A: De formule voor dilithiumoxide is Li2O.
Vraag: Is lithiumoxide ionisch of covalent?
A: Dilithiumoxide is ionisch.
Vraag: Wat is het oxidatiegetal van lithium in een ionische binding?
A: Het oxidatiegetal van lithium in een ionische binding is +1.
Vraag: Coördinatiegetal van lithium in Li2O?
A: Het coördinatiegetal van lithium in Li2O is 4.
Vraag: Is Li2O ionisch of covalent?
A: Li2O is ionisch.
Vraag: Welke van de volgende reacties houdt verband met de roosterenergie van Li2O (ΔH°latt)?
A: De reactie: Li+(g) + O2-(g) → Li2O(s)
Vraag: Wat is de molaire massa van lithiumoxide, Li2O?
A: De molaire massa van Li2O is ongeveer 29,88 g/mol.
Vraag: Welke van de volgende stoffen ontstaat bij het verbranden van lithiummetaal (Li)? O2, LiO, H2O, Li2O?
A: Li2O wordt geproduceerd tijdens de verbranding van metallisch lithium (Li).
Vraag: Hoeveel gram zit er in 4,5 mol Li2O?
A: Er zit ongeveer 134,46 gram in 4,5 mol Li2O.
