Lithiumcarbonaat (Li2CO3) is een essentiële verbinding die wordt gebruikt in stemmingsstabiliserende medicijnen. Het behandelt een bipolaire stoornis en helpt depressie effectief te beheersen, waardoor het algehele mentale welzijn wordt bevorderd.
| IUPAC-naam | Lithiumcarbonaat |
| Moleculaire formule | Li2CO3 |
| CAS-nummer | 554-13-2 |
| Synoniemen | Dilithiumcarbonaat; Koolzuur, dilithiumzout; Lithiumcarbonaat(1+); Koolzuur, lithiumzout (1:1) |
| InChi | InChI=1S/CH2O3.2Li/c2-1(3)4;;/h(H2,2,3,4);;/q;2*+1/p-2 |
Eigenschappen van lithiumcarbonaat
Lithiumcarbonaatformule
De formule voor dilithiumcarbonaat is Li2CO3. Dit betekent dat elk molecuul twee lithiumatomen (Li), één koolstofatoom (C) en drie zuurstofatomen (O) bevat. Deze chemische samenstelling speelt een cruciale rol in de eigenschappen en toepassingen ervan.
Molaire massa van lithiumcarbonaat
De molaire massa van dilithiumcarbonaat is ongeveer 73,89 g/mol. Het wordt berekend door de atoommassa’s van de samenstellende elementen op te tellen, rekening houdend met hun respectieve verhoudingen in de formule. Deze waarde is essentieel voor verschillende chemische berekeningen en reacties waarbij dilithiumcarbonaat betrokken is.
Kookpunt van lithiumcarbonaat
Dilithiumcarbonaat heeft een hoog kookpunt, doorgaans rond de 1.310 graden Celsius (2.390 graden Fahrenheit). Bij deze temperatuur transformeert de verbinding van vloeistof naar gas, waardoor deze geschikt is voor specifieke industriële processen en toepassingen.
Lithiumcarbonaat Smeltpunt
Dilithiumcarbonaat heeft een relatief laag smeltpunt, doorgaans rond de 720 graden Celsius (1328 graden Fahrenheit). Bij deze temperatuur verandert de verbinding van vast in vloeibaar, waardoor het gebruik ervan bij het maken van keramiek, glas en andere materialen wordt vergemakkelijkt.
Dichtheid van lithiumcarbonaat g/ml
De dichtheid van dilithiumcarbonaat is ongeveer 2,11 g/ml. Deze waarde vertegenwoordigt de massa per volume-eenheid en geeft aan hoe dicht de deeltjes op elkaar zijn gepakt. De dichtheid van dilithiumcarbonaat is cruciaal voor het begrijpen van de fysieke eigenschappen en het gedrag ervan.
Lithiumcarbonaat molecuulgewicht
Dilithiumcarbonaat heeft een molecuulgewicht van ongeveer 73,89 g/mol. Deze waarde komt overeen met de massa van één mol van de verbinding en is essentieel bij verschillende chemische berekeningen, zoals het bepalen van het aantal mol in een bepaalde hoeveelheid stof.
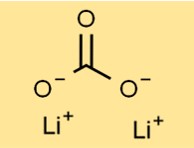
Structuur van lithiumcarbonaat
Dilithiumcarbonaat heeft een kristallijne structuur en vormt een wit, geurloos poeder. De opstelling ervan bestaat uit Li+-kationen en carbonaatanionen (CO3^2-) die bij elkaar worden gehouden door ionische bindingen. Deze specifieke opstelling draagt bij aan de stabiliteit en reactiviteit van de verbinding.
Oplosbaarheid van lithiumcarbonaat
Dilithiumcarbonaat heeft een beperkte oplosbaarheid in water. Het lost tot op zekere hoogte op en vormt een licht alkalische oplossing. De oplosbaarheid van dilithiumcarbonaat is een kritische overweging in farmaceutische formuleringen en andere toepassingen waarbij gecontroleerde oplossing vereist is.
| Verschijning | Wit, geurloos poeder |
| Soortelijk gewicht | 2,11 g/ml |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 73,89 g/mol |
| Dikte | 2,11 g/ml |
| Fusie punt | 720°C (1328°F) |
| Kookpunt | 1310°C (2390°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Beperkte oplosbaarheid |
| Oplosbaarheid | Oplosbaar in water en vormt een licht alkalische oplossing |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Licht alkalisch |
Veiligheid en gevaren van lithiumcarbonaat
Dilithiumcarbonaat brengt potentiële veiligheidsrisico’s met zich mee die zorgvuldige omgang vereisen. Direct contact met de huid kan irritatie veroorzaken, terwijl inslikken maag-darmklachten kan veroorzaken. Bij overmatige blootstelling kan dit schadelijke effecten op het zenuwstelsel veroorzaken. Om mogelijke gevaren te voorkomen, moeten de juiste veiligheidsmaatregelen, zoals het dragen van beschermende uitrusting, worden gevolgd bij het hanteren ervan. Het is van cruciaal belang om dilithiumcarbonaat op te slaan en te transporteren uit de buurt van onverenigbare stoffen en bronnen van hitte of vuur. In noodsituaties dient u onmiddellijk medische hulp in te roepen. Veiligheidsinformatiebladen en richtlijnen moeten zorgvuldig worden beoordeeld en gevolgd bij het werken met dilithiumcarbonaat.
| Gevarensymbolen | Bijtend, irriterend |
| Beveiligingsbeschrijving | Kan irritatie veroorzaken. Vermijd inname. Gebruiken met voldoende ventilatie. Draag beschermende uitrusting. |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | 2836.40.00 |
| Gevarenklasse | Niet geclassificeerd als gevaarlijk |
| Verpakkingsgroep | Niet geclassificeerd |
| Toxiciteit | Lage toxiciteit |
Synthesemethoden voor lithiumcarbonaat
Er bestaan verschillende methoden voor het synthetiseren van dilithiumcarbonaat.
Een gebruikelijke aanpak is om lithiumverbindingen, zoals lithiumhydroxide of lithiumoxide, onder gecontroleerde omstandigheden te onderwerpen aan kooldioxide. De reactie produceert lithiumcarbonaat en water als bijproduct. Een andere methode omvat het mengen van oplosbare lithiumzouten , zoals lithiumchloride, met een oplosbare carbonaatverbinding. De reactie vormt een vast neerslag van lithiumcarbonaat, dat onderzoekers kunnen scheiden en verzamelen.
Bovendien is het mogelijk dilithiumcarbonaat te produceren door thermische ontleding van lithiumbicarbonaat. Wanneer lithiumbicarbonaat wordt verwarmd, valt het uiteen in lithiumcarbonaat, waarbij kooldioxide en water vrijkomen. Sommige industriële omgevingen gebruiken dit proces om lithiumcarbonaat met hoge zuiverheid te verkrijgen.
Om de gewenste opbrengsten en zuiverheidsniveaus te bereiken, ongeacht de gebruikte methode, moeten ze zorgen voor een passende controle van reactieparameters, zoals temperatuur, druk en stoichiometrie. De synthese van dilithiumcarbonaat speelt een cruciale rol bij de productie van deze verbinding voor verschillende toepassingen, waaronder farmaceutische producten, keramiek en batterijen.
Gebruik van lithiumcarbonaat
Dilithiumcarbonaat vindt verschillende toepassingen vanwege zijn unieke eigenschappen. Dit zijn de belangrijkste toepassingen:
- Geneesmiddelen: Het is een essentieel onderdeel van stemmingsstabiliserende medicijnen, die bipolaire stoornissen en depressie effectief behandelen en het geestelijk welzijn bevorderen.
- Batterijen: In oplaadbare lithium-ionbatterijen dient dilithiumcarbonaat als een voorloper van lithiumverbindingen en speelt het een cruciale rol in technologieën voor energieopslag.
- Pyrotechniek: De exotherme reactie van dilithiumcarbonaat met bepaalde chemicaliën maakt het waardevol in vuurwerk en fakkels.
- Chemische synthese: Als bron van lithiumionen is het essentieel bij verschillende chemische reacties en organische syntheses.
- Bron van alkalimetalen: Het fungeert als een bron van lithium in laboratoria en onderzoek, gebruikt om de eigenschappen van alkalimetalen te bestuderen.
- Milieutoepassingen: Dilithiumcarbonaat helpt bij het reguleren van de pH in waterbehandelingsprocessen en controleert de zuurgraad en alkaliteit.
- Keramiek en glas: Dilithiumcarbonaat verbetert de stabiliteit van keramische en glasproducten door als vloeimiddel te dienen, waardoor de smelttemperaturen worden verlaagd.
- Metallurgie: In de metallurgie verfijnt dilithiumcarbonaat metalen zoals aluminium en koper, waardoor onzuiverheden effectief worden verwijderd en hun mechanische eigenschappen worden verbeterd.
- Airconditioning: Droogmiddelen in airconditioningsystemen gebruiken dilithiumcarbonaat om effectief vocht te absorberen, waardoor optimale airconditioningprestaties worden gegarandeerd.
Over het geheel genomen onderstreept het brede scala aan toepassingen van dilithiumcarbonaat het belang ervan in alle sectoren, waardoor het een waardevolle verbinding is in de moderne technologie, geneeskunde en materiaalkunde.
Vragen:
Vraag: Welk van de volgende elementen heeft de minste valentie-elektronen?
A: Beryllium heeft de minste valentie-elektronen, met slechts twee.
Vraag: Waar wordt lithiumcarbonaat voor gebruikt?
A: Dilithiumcarbonaat wordt gebruikt in stemmingsstabiliserende medicijnen om bipolaire stoornissen en depressie te behandelen.
Vraag: Is dilithiumcarbonaat oplosbaar?
A: Ja, dilithiumcarbonaat is in beperkte mate oplosbaar in water.
Vraag: Hoe werkt lithiumcarbonaat?
A: Dilithiumcarbonaat werkt door de stemming te stabiliseren en de neurotransmitters in de hersenen in evenwicht te brengen.
Vraag: Wat behandelt lithiumcarbonaat?
A: Dilithiumcarbonaat wordt in de psychiatrische geneeskunde gebruikt voor de behandeling van bipolaire stoornissen en depressie.
Vraag: Is LiNO3 ionisch of covalent?
A: LiNO3 is ionisch.
Vraag: Welke van de volgende stoffen is onoplosbaar in water? Li2CO3, NaOH, PbCl2, Ba(OH)2, (NH4)2S.
A: PbCl2 en Ba(OH)2 zijn onoplosbaar in water.
Vraag: Is Li2CO3 oplosbaar in water?
A: Li2CO3 is enigszins oplosbaar in water.
Vraag: Hoeveel ionen zitten er in Li2CO3?
A: Li2CO3 bevat drie ionen: twee Li+-ionen en één CO3^2–ion.
Vraag: Hoeveel formule-eenheden zitten er in 0,0067 g Li2CO3?
A: Er zitten ongeveer 1,24 x 10^20 formule-eenheden in 0,0067 g Li2CO3.
Vraag: Hoeveel lithiumionen zijn er aanwezig in 30,0 ml 0,600 M Li2CO3-oplossing?
A: Er zitten 0,036 mol Li+-ionen in 30,0 ml 0,600 M Li2CO3-oplossing.
Vraag: Wat is de massapercentagesamenstelling van koolstof in lithiumcarbonaat, Li2CO3?
A: De massapercentage-samenstelling van koolstof in Li2CO3 is ongeveer 11,3%.
Vraag: Welke van de volgende paren waterige oplossingen zullen een neerslag vormen bij het mengen van NH4NO3 + Li2CO3?
A: NH4NO3 + Li2CO3 vormen geen neerslag omdat beide verbindingen oplosbaar zijn in water.
