Lithiumnitraat (LiNO₃) is een chemische verbinding die in verschillende toepassingen wordt gebruikt. Het vertoont unieke eigenschappen, zoals de oplosbaarheid in water en zijn rol in de productie van keramiek en glas.
| IUPAC-naam | Lithiumnitraat |
| Moleculaire formule | LiNO₃ |
| CAS-nummer | 7790-69-4 |
| Synoniemen | Lithiumnitraat, lithiumzout van salpeterzuur, lithium (I) nitraat |
| InChi | InChI=1S/Li.NO3/c;2-1(3)4/q+1;-1 |
Eigenschappen van lithiumnitraat
Lithiumnitraatformule
De formule voor het lithiumzout van salpeterzuur is LiNO₃. Het bestaat uit één lithium (Li), één stikstofatoom (N) en drie zuurstofatomen (O). Deze chemische formule vertegenwoordigt de samenstelling van elk element in de verbinding.
Molaire massa van lithiumnitraat
Het lithiumzout van salpeterzuur heeft een molaire massa van ongeveer 68,95 g/mol. Molaire massa verwijst naar de massa van één mol van een stof en wordt berekend door de atoommassa’s van alle atomen in de formule bij elkaar op te tellen.
Kookpunt van lithiumnitraat
Het lithiumzout van salpeterzuur heeft een kookpunt van ongeveer 600°C (1112°F). Kookpunt is de temperatuur waarbij een stof onder standaard atmosferische druk verandert van een vloeistof in een gas.
Smeltpunt van lithiumnitraat
Het lithiumzout van salpeterzuur heeft een smeltpunt van ongeveer 255°C (491°F). Het smeltpunt is de temperatuur waarbij een stof onder normale atmosferische druk verandert van een vaste stof in een vloeistof.
Dichtheid van lithiumnitraat g/ml
De dichtheid van het lithiumzout van salpeterzuur is ongeveer 2,38 g/ml. De dichtheid vertegenwoordigt de massa van een stof per volume-eenheid en is een belangrijke eigenschap voor het begrijpen van het fysieke gedrag ervan.
Lithium-nitraat molecuulgewicht
Het molecuulgewicht van het lithiumzout van salpeterzuur is 68,95 g/mol. Het molecuulgewicht is de som van de atoomgewichten van alle atomen in een molecuul en wordt uitgedrukt in gram per mol.
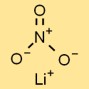
Structuur van lithiumnitraat
Het lithiumzout van salpeterzuur heeft een ionische kristalstructuur, waarbij lithiumkationen (Li⁺) en nitraatanionen (NO₃⁻) een regelmatig herhalend patroon vormen. Deze structuur draagt bij aan de stabiliteit en karakteristieke eigenschappen.
Oplosbaarheid van lithiumnitraat
Het lithiumzout van salpeterzuur is zeer oplosbaar in water. Deze hoge oplosbaarheid is een van de essentiële kenmerken ervan en maakt het bruikbaar in verschillende toepassingen, zoals bij de productie van keramiek en glas.
| Verschijning | Witte vaste stof |
| Soortelijk gewicht | N.v.t |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 68,95 g/mol |
| Dikte | 2,38 g/ml |
| Fusie punt | 255°C (491°F) |
| Kookpunt | 600°C (1112°F) |
| Flitspunt | N.v.t |
| oplosbaarheid in water | Zeer oplosbaar |
| Oplosbaarheid | Oplosbaar in water en organische oplosmiddelen zoals ethanol |
| Dampdruk | N.v.t |
| Dampdichtheid | N.v.t |
| pKa | N.v.t |
| pH | N.v.t |
Houd er rekening mee dat sommige eigenschappen mogelijk niet van toepassing zijn (n.v.t.) of dat er beperkte gegevens beschikbaar zijn voor lithiumnitraat.
Veiligheid en gevaren van lithiumnitraat
Het lithiumzout van salpeterzuur brengt bepaalde veiligheids- en gevaaroverwegingen met zich mee. Het kan irriterend zijn voor de huid, ogen en luchtwegen bij contact of inademing. Bij het hanteren is het essentieel om geschikte beschermende uitrusting te gebruiken, zoals handschoenen en een veiligheidsbril. Vermijd inname, omdat dit maag-darmklachten kan veroorzaken. Bewaar het uit de buurt van onverenigbare stoffen om gevaarlijke reacties te voorkomen. Als er gemorst of gelekt wordt, moet u deze onmiddellijk indammen en schoonmaken. Volg bovendien altijd de juiste opslagrichtlijnen en bewaar deze in een veilige, goed geventileerde ruimte. Geef prioriteit aan veilige hanteringspraktijken en volg relevante veiligheidsprotocollen om de risico’s die verband houden met lithiumzout van salpeterzuur te minimaliseren.
| Gevarensymbolen | Waarschuwing |
| Beveiligingsbeschrijving | – Irriterend voor de huid, ogen en luchtwegen. – Vermijd inslikken. – Gebruik beschermende uitrusting. – Op een goed geventileerde plaats bewaren. |
| VN-identificatienummers | VN1477 |
| HS-code | 28342990 |
| Gevarenklasse | 5.1 (Oxidatiemiddel) |
| Verpakkingsgroep | II |
| Toxiciteit | Lage toxiciteit, maar moet met zorg en met passende veiligheidsmaatregelen worden behandeld. |
Houd er rekening mee dat specifieke gevarensymbolen en veiligheidsaanbevelingen kunnen variëren, afhankelijk van het rechtsgebied en de regelgeving. Raadpleeg altijd de juiste veiligheidsinformatiebladen en lokale veiligheidsrichtlijnen bij het hanteren van lithiumzout of salpeterzuur.
Synthesemethoden voor lithiumnitraat
Er zijn verschillende methoden voor het synthetiseren van het lithiumzout van salpeterzuur.
Een veel voorkomende aanpak is de reactie tussen lithiumcarbonaat (Li₂CO₃) en salpeterzuur (HNO₃) . Tijdens dit proces reageren de twee verbindingen om lithiumzout van salpeterzuur en water (H₂O) als bijproducten te produceren. De chemische vergelijking voor deze reactie is:
Li₂CO₃ + 2HNO₃ → 2LiNO₃ + H₂O
Een andere methode is om lithiumhydroxide (LiOH) te laten reageren met salpeterzuur om het lithiumzout van salpeterzuur en water te verkrijgen. De reactievergelijking is:
LiOH + HNO₃ → LiNO₃ + H₂O
Het lithiumzout van salpeterzuur wordt gevormd door salpeterzuur te neutraliseren met lithiumoxide (Li₂O) of lithiumcarbonaat. De vergelijkingen zijn:
Li₂O + 2HNO₃ → 2LiNO₃ + H₂O Li₂CO₃ + 2HNO₃ → 2LiNO₃ + CO₂ + H₂O
Bij al deze methoden is het belangrijk om voorzichtig om te gaan met de reagentia en producten vanwege hun reactiviteit en potentiële gevaren. Goede veiligheidsmaatregelen en gecontroleerde omstandigheden zijn essentieel tijdens het syntheseproces om een succesvolle productie van lithiumzout van salpeterzuur te garanderen.
Gebruik van lithiumnitraat
Lithiumzout van salpeterzuur vindt vanwege zijn unieke eigenschappen diverse toepassingen. Hier zijn de toepassingen:
- Luchtbehandeling: Lithiumzout van salpeterzuur werkt als droogmiddel bij luchtbehandelingstoepassingen, waarbij vocht uit de lucht wordt verwijderd om corrosie te voorkomen en optimale omgevingscondities te behouden.
- Reagentia bij chemische synthese: Het dient als bron van nitraationen bij verschillende chemische reacties, waardoor het bruikbaar is bij de synthese van andere verbindingen en stoffen.
- Speciale chemicaliën: Deze vinden toepassingen bij de productie van speciale chemicaliën, waaronder katalysatoren en corrosieremmers.
- Pyrotechniek en vuurwerk: Het lithiumzout van salpeterzuur speelt een cruciale rol als oxidatiemiddel bij pyrotechniek en draagt bij aan de felrode kleur die in vuurwerk te zien is.
- Farmaceutische industrie: De farmaceutische industrie gebruikt lithiumzout van salpeterzuur als reagens bij de chemische synthese en onderzoek voor bepaalde farmaceutische formuleringen.
- Lithiumbatterijen: Hoewel lithiumzout van salpeterzuur niet rechtstreeks in batterijen wordt gebruikt, is het relevant voor de lithium-ionbatterijindustrie. Fabrikanten verwerken lithiumzouten afgeleid van het lithiumzout van salpeterzuur in de elektrolyten die in deze batterijen worden gebruikt.
- Kernreactoren: Sommige soorten kernreactoren gebruiken lithiumzout van salpeterzuur als koelmiddel vanwege de neutronenabsorptie-eigenschappen.
- Keramiek- en glasproductie: Bij de vervaardiging van keramiek en glas werkt het lithiumzout van salpeterzuur als vloeimiddel. Het verlaagt effectief het smeltpunt van materialen, waardoor hun verwerkbaarheid en productkwaliteit worden verbeterd.
- Warmteoverdrachtsvloeistoffen: Lithiumzout van salpeterzuur vindt toepassing in warmteoverdrachtsvloeistoffen, vooral in zonne-energiesystemen, vanwege de hoge oplosbaarheid in water. Het vergemakkelijkt een efficiënte warmte-uitwisseling en maakt de opslag van thermische energie mogelijk.
Vragen:
Vraag: Hoeveel atomen zitten er in totaal in een molecuul lithiumnitraat, LiNO₃?
A: Er zijn 5 atomen in een molecuul lithiumzout van salpeterzuur: 1 lithiumatoom (Li), 1 stikstofatoom (N) en 3 zuurstofatomen (O).
Vraag: Wat zijn de juiste formules voor koper(II)nitraathexahydraat en lithiumchromaatdihydraat?
A: De juiste formules zijn Cu(NO₃)₂·6H₂O voor koper(II)nitraat-hexahydraat en Li₂CrO₄·2H₂O voor lithiumchromaat-dihydraat.
Vraag: Hoeveel gram lithiumnitraat is nodig om 250 ml van een 0,5 M-oplossing te bereiden?
A: U heeft 17,24 gram lithiumzout van salpeterzuur nodig om 250 ml van een 0,5 M oplossing te bereiden.
Vraag: Is lithiumnitraat ionisch of covalent?
A: Het lithiumzout van salpeterzuur is een ionische verbinding.
Vraag: Is LiNO₃ oplosbaar in water?
A: Ja, lithiumnitraat (LiNO₃) is oplosbaar in water.
Vraag: Welke coëfficiënt moet vóór LiNO₃ verschijnen in de gebalanceerde vergelijking?
A: De coëfficiënt “2” moet vóór LiNO₃ in de gebalanceerde vergelijking verschijnen.
Vraag: Hoeveel van de volgende verbindingen zijn oplosbaar in water? Pb(OH)₂, LiNO₃, NH₄Br, K₂S
A: Drie van de verbindingen zijn in water oplosbaar: LiNO₃, NH₄Br en K₂S.
Vraag: Is LiNO₃ oplosbaar?
A: Ja, LiNO₃ is oplosbaar.
Vraag: Is LiNO₃ waterig of vast?
A: LiNO₃ is waterig wanneer opgelost in water.
Vraag: Is LiNO₃ zuur, basisch of neutraal?
A: Lithiumzout van salpeterzuur (LiNO₃) is een neutrale verbinding.
Vraag: Hoeveel atomen zitten er in totaal in een molecuul lithiumnitraat, LiNO₃?
A: Er zijn 5 atomen in een lithiumnitraatmolecuul: 1 lithium (Li) atoom, 1 stikstof (N) atoom en 3 zuurstof (O) atomen.
Vraag: Is LiNO₃ ionisch of covalent?
A: LiNO₃ is een ionische verbinding.
