Goudoxide (Au2O3) is een verbinding gemaakt van goud en zuurstof. Het vertoont andere eigenschappen dan metallisch goud, waardoor het interessant is voor diverse wetenschappelijke en industriële toepassingen.
| IUPAC-naam | Goud(III)oxide |
| Moleculaire formule | Au2O3 |
| CAS-nummer | 1303-58-8 |
| Synoniemen | Aurineoxide, goudsesquioxide, goudtrioxide, digoldtrioxide |
| InChi | InChI=1S/2Au.3O |
Eigenschappen van goud(III)oxide
Goudoxide-formule
De formule voor goudtrioxide is Au2O3. Het is samengesteld uit twee goudatomen en drie zuurstofatomen. Deze chemische formule geeft de verhouding van elementen in de verbinding aan.
Molaire massa van goudoxide
De molaire massa van goudtrioxide (Au2O3) kan worden berekend door de atoommassa’s van de samenstellende elementen op te tellen. De molaire massa van goud (Au) is 196,97 g/mol en die van zuurstof (O) is 16,00 g/mol. De molaire massa van Au2O3 is dus ongeveer 441,97 g/mol.
Kookpunt van goudoxide
Goudtrioxide heeft geen duidelijk kookpunt, omdat het ontleding ondergaat voordat het een kookpunt bereikt. Bij verhitting valt het uiteen in de samenstellende elementen.
Smeltpunt van goudoxide
Goudtrioxide heeft een smeltpunt van ongeveer 1.600 ° C (2.912 ° F). Bij deze temperatuur gaat vast goudtrioxide over naar een vloeibare toestand, wat verschillende toepassingen in processen bij hoge temperaturen mogelijk maakt.
Dichtheid van goudoxide g/ml
De dichtheid van goudtrioxide is ongeveer 11,34 g/ml. Deze waarde geeft de massa per volume-eenheid aan en duidt op de hoge dichtheid ervan in vergelijking met veel andere materialen.
Molecuulgewicht van goudoxide
Het molecuulgewicht van goudtrioxide (Au2O3) is ongeveer 441,97 g/mol. Deze waarde vertegenwoordigt de som van de atoomgewichten van alle atomen in een molecuul van de verbinding.
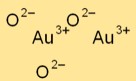
Structuur van goudoxide
Goudtrioxide (Au2O3) heeft een complexe kristalstructuur. Het beschikt over een ruitvormige roosteropstelling, waarbij goud- en zuurstofatomen specifieke patronen vormen binnen het kristalrooster.
Oplosbaarheid van goudoxide
Goudtrioxide (Au2O3) is over het algemeen onoplosbaar in water en de meeste organische oplosmiddelen. Het vertoont een lage oplosbaarheid, wat betekent dat slechts sporenhoeveelheden oplossen, wat leidt tot de vaak lage reactiviteit in waterige oplossingen.
| Verschijning | Stevig |
| Soortelijk gewicht | N.v.t |
| Kleur | Zwart of bruinzwart |
| Geur | Geurloos |
| Molaire massa | 441,97 g/mol |
| Dikte | 11,34 g/ml |
| Fusie punt | 1600°C (2912°F) |
| Kookpunt | Ontbonden |
| Flitspunt | N.v.t |
| oplosbaarheid in water | Onoplosbaar |
| Oplosbaarheid | lage reactiviteit in waterige oplossingen |
| Dampdruk | N.v.t |
| Dampdichtheid | N.v.t |
| pKa | N.v.t |
| pH | N.v.t |
Veiligheid en gevaren van goudoxide
Goudtrioxide brengt verschillende veiligheids- en gevarenoverwegingen met zich mee. Het kan irriterend zijn als het in contact komt met de huid, ogen of luchtwegen. Tijdens het hanteren moeten geschikte beschermende uitrustingen, zoals handschoenen en een veiligheidsbril, worden gebruikt. Bovendien is goudtrioxide niet geschikt voor inslikken of inademen, omdat het nadelige gevolgen voor de gezondheid kan hebben. Zorg bij het werken met dit middel voor goede ventilatie om het risico op blootstelling aan stof of dampen te minimaliseren. Bovendien moet u, in geval van accidentele inname of blootstelling, onmiddellijk medische hulp inroepen. Goede opslag- en hanteringspraktijken zijn essentieel om het veilige gebruik van goudtrioxide in laboratorium- en industriële omgevingen te garanderen.
| Gevarensymbolen | Irriterend |
| Beveiligingsbeschrijving | Irriterend, Inademing vermijden, Huidcorrosie, Ernstig oogletsel |
| VN-identificatienummers | N.v.t |
| HS-code | N.v.t |
| Gevarenklasse | N.v.t |
| Verpakkingsgroep | N.v.t |
| Toxiciteit | Zwak |
Houd er rekening mee dat sommige eigenschappen, zoals UN-identificaties, HS-code, gevarenklasse en verpakkingsgroep, mogelijk niet van toepassing zijn of niet goed gedefinieerd zijn voor goudoxide.
Goudoxidesynthesemethoden
Verschillende methoden maken de synthese van goudtrioxide mogelijk.
Een gebruikelijke aanpak omvat de reactie van metallisch goud met ozongas bij verhoogde temperaturen. Tijdens dit proces reageert goud met ozon en vormt goudtrioxide. Een andere methode omvat de thermische ontleding van goudzouten, zoals goudnitraat of goudhydroxide. Bij verhitting ontleden deze verbindingen, waarbij goudtrioxide als een van de producten ontstaat.
Goudtrioxide kan worden bereid door precipitatie. Hierbij wordt een goudzoutoplossing gemengd met een geschikt precipitatiemiddel, zoals een alkalimetaalhydroxide, NaOH . Vervolgens levert verdere verwerking van het resulterende neerslag zuiver goudtrioxide op.
Bovendien kan de elektrolyse van een goudhoudende elektrolyt leiden tot de vorming van goudtrioxide op het oppervlak van de anode. Deze methode is vooral nuttig voor het produceren van dunne films van goudtrioxide.
Onderzoekers kunnen een specifieke synthesemethode kiezen op basis van factoren zoals de gewenste zuiverheid, deeltjesgrootte en toepassing van goudtrioxide. Zorgvuldige controle van de reactieomstandigheden is essentieel om het gewenste product te verkrijgen met optimale eigenschappen voor specifieke toepassingen.
Gebruik van goudoxide
Goudtrioxide vindt diverse toepassingen vanwege zijn unieke eigenschappen. Hier zijn de toepassingen:
- Katalyse: Goudtrioxide fungeert als katalysator bij bepaalde chemische reacties, waaronder de oxidatie van koolmonoxide en andere koolwaterstoffen. Het is waardevol in industriële processen vanwege zijn katalytische efficiëntie.
- Glaskleuring: Goudtrioxide geeft glas een karakteristieke rode kleur, waardoor het nuttig is voor decoratieve doeleinden en voor het maken van glas-in-loodkunst.
- Onderzoek: Wetenschappers gebruiken goudtrioxide in verschillende onderzoeken, waaronder katalyseonderzoek, materiaalkunde en nanotechnologie.
- Fotokatalyse: Goudtrioxide vertoont fotokatalytische eigenschappen, waardoor organische verontreinigende stoffen in water en lucht kunnen worden afgebroken bij blootstelling aan licht.
- Brandstofcellen: Goudtrioxide dient als katalysator in brandstofcellen, verbetert de elektrochemische reacties en verbetert hun efficiëntie.
- Chemische synthese: Goudtrioxide vergemakkelijkt de synthese van andere goudverbindingen, zoals gouden nanodeeltjes, die op verschillende gebieden toepassing vinden.
- Geneeskunde: Onderzoekers hebben de potentiële medische toepassingen van goudtrioxide onderzocht, waaronder de behandeling van kanker en de antimicrobiële eigenschappen ervan.
- Sensortechnologie: Fabrikanten gebruiken goudtrioxidesensoren in gasdetectieapparatuur, omgevingsmonitoring en detectie van gevaarlijke stoffen.
- Elektronica: Fabrikanten gebruiken dunne films van goudtrioxide in de elektronica, bijvoorbeeld bij de vervaardiging van halfgeleiders en weerstanden, vanwege het hoge smeltpunt en de stabiliteit ervan.
- Nanotechnologie: In de nanotechnologie gebruiken onderzoekers nanodeeltjes van goudtrioxide als veelbelovende materialen voor medicijnafgiftesystemen en medische diagnostiek, dankzij hun biocompatibiliteit.
Deze toepassingen tonen de veelzijdigheid en het belang van goudtrioxide in verschillende industrieën aan en dragen bij aan vooruitgang in technologie, wetenschap en gezondheidszorg.
Vragen:
Vraag: Wat is het oxidatiegetal van Au in Au2O3?
A: Het oxidatiegetal van Au in Au2O3 is +3.
Vraag: Welk volume O2 bij STP wordt geproduceerd door de reactie van 212 gram Au2O3?
A: Er zal ongeveer 160,7 liter O2 bij STP worden geproduceerd uit de reactie van 212 gram Au2O3.
Vraag: Waar wordt Au2O3 voor gebruikt?
A: Au2O3 heeft toepassingen als katalysator in de elektronica, nanotechnologie, glaskleuring en onderzoeksstudies.
Vraag: Hoeveel gram goud zit er in één ton (1000 kg) Au2O3?
A: Er zit ongeveer 432,09 gram goud in één metrische ton (1000 kg) Au2O3.
Vraag: Hoeveel gram goud zit er in een ton Au2O3?
A: Er zal ongeveer 432.090 gram goud in een ton Au2O3 zitten.
Vraag: Is goud(III)oxide ionisch of moleculair?
A: Goud(III)oxide (Au2O3) is een ionische verbinding.
Vraag: Waar wordt goud(III)oxide voor gebruikt?
A: Goud(III)oxide wordt gebruikt in katalyse, elektronica, nanotechnologie, glaskleuring en brandstofceltoepassingen.
Vraag: Wat is de chemische formule voor goud(III)oxide?
A: De chemische formule voor goud(III)oxide is Au2O3.
