Nikkel(II)oxide is een chemische verbinding met de formule NiO. Het is een zwarte vaste stof, die vaak wordt gebruikt als katalysator en bij de productie van keramiek en pigmenten.
| IUPAC-naam | Nikkel(II)oxide |
| Moleculaire formule | NiO |
| CAS-nummer | 1313-99-1 |
| Synoniemen | Nikkeloxide, nikkelmonoxide, Ni(II)oxide |
| InChi | InChI=1S/Ni.O |
Eigenschappen van nikkel(II)oxide
Nikkel(II)oxideformule
De chemische formule voor nikkelmonoxide is NiO. Het bestaat uit één nikkelatoom (Ni) en één zuurstofatoom (O), wat resulteert in een eenvoudige en duidelijke formule.
Nikkel(II)oxide molaire massa
De molaire massa van nikkelmonoxide kan worden berekend door de atoommassa’s van de samenstellende elementen op te tellen. Voor NiO bedraagt de molaire massa ongeveer 74,69 gram per mol (g/mol).
Kookpunt van nikkel(II)oxide
Nikkelmonoxide heeft geen duidelijk kookpunt omdat het ontleding ondergaat voordat het zijn kookpunt bereikt. Bij verhitting valt het uiteen in de samenstellende elementen, nikkel en zuurstof.
Nikkel(II)oxide Smeltpunt
Het smeltpunt van nikkelmonoxide is ongeveer 1984 graden Celsius (1984 °C). Bij deze temperatuur verandert vast NiO in een vloeibare toestand.
Dichtheid van nikkel(II)oxide g/ml
De dichtheid van nikkelmonoxide is ongeveer 6,67 gram per milliliter (g/ml). Deze waarde geeft de hoeveelheid massa aan die in een bepaald volume is verpakt, waardoor het een maatstaf is voor de compactheid van de stof.
Nikkel(II)oxide-molecuulgewicht
Het molecuulgewicht van nikkelmonoxide wordt berekend door de atoomgewichten van de samenstellende elementen op te tellen. Voor NiO bedraagt het molecuulgewicht ongeveer 74,69 gram per mol (g/mol).
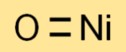
Structuur van nikkel(II)oxide
Nikkelmonoxide heeft een kubieke kristalstructuur. Het bestaat uit nikkelionen (Ni2+) en oxide-ionen (O2-) gerangschikt in een regelmatig, herhalend patroon. Deze structuur draagt bij aan de karakteristieke eigenschappen en het gedrag ervan.
Oplosbaarheid van nikkel(II)oxide
Nikkelmonoxide is slecht oplosbaar in water. Het heeft een beperkte oplosbaarheid, wat betekent dat het slechts in kleine mate oplost in water. Het kan echter reageren met zuren om oplosbare nikkelzouten te vormen, waarbij het een zekere mate van chemische reactiviteit vertoont.
| Verschijning | Effen zwart |
| Soortelijk gewicht | 6,67 g/ml |
| Kleur | Zwart |
| Geur | Geurloos |
| Molaire massa | 74,69 g/mol |
| Dikte | 6,67 g/ml |
| Fusie punt | 1984°C |
| Kookpunt | Ontbonden |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Slecht oplosbaar |
| Oplosbaarheid | Oplosbaar in zuren, vormt oplosbare nikkelzouten |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet toepasbaar |
| pH | Neutrale |
Houd er rekening mee dat sommige eigenschappen, zoals vlampunt, dampspanning en pKa, niet van toepassing of beschikbaar zijn voor nikkelmonoxide.
Veiligheid en gevaren van nikkel(ii)oxide
Nikkelmonoxide brengt bepaalde veiligheidsoverwegingen en gevaren met zich mee. Het is belangrijk om er voorzichtig mee om te gaan. Direct contact met de huid, ogen of inademing van stof of damp moet worden vermeden. Dit kan bij sommige mensen huidirritatie en allergische reacties veroorzaken. Bij inslikken of inademen is onmiddellijke medische hulp vereist. Nikkelmonoxide wordt niet als licht ontvlambaar beschouwd, maar kan bijdragen aan brand als het wordt blootgesteld aan brandbare materialen. Het is belangrijk om het in een goed geventileerde ruimte op te slaan en te hanteren. Bij het werken met nikkelmonoxide moeten geschikte persoonlijke beschermingsmiddelen, zoals handschoenen en een veiligheidsbril, worden gedragen om potentiële risico’s te minimaliseren.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Breekbaar. Vermijd direct contact en inademing. Gebruik geschikte beschermende uitrusting. Roep indien nodig medische hulp in. |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | 2825.70.10 |
| Gevarenklasse | Niet geclassificeerd |
| Verpakkingsgroep | Niet geclassificeerd |
| Toxiciteit | Beschouwd als schadelijk bij inslikken of inademen. Kan huidirritatie en allergische reacties veroorzaken. |
Houd er rekening mee dat nikkelmonoxide geen specifieke gevarensymbolen, UN-identificaties, gevarenklasse of verpakkingsgroep draagt. De verstrekte veiligheidsinformatie is gebaseerd op algemene kennis en voorzorgsmaatregelen in verband met de hantering en het gebruik van nikkelmonoxide. Het is essentieel om specifieke veiligheidsinformatiebladen (SDS) te raadplegen en de aanbevolen veiligheidspraktijken te volgen voor nauwkeurige en gedetailleerde informatie.
Methoden voor de synthese van nikkel(ii)oxide
Er zijn verschillende methoden voor het synthetiseren van nikkelmonoxide. Een gebruikelijke aanpak is de thermische ontleding van nikkelverbindingen, zoals nikkelcarbonaat of nikkelhydroxide. Bij deze methode wordt een specifieke precursorverbinding verwarmd in afwezigheid van zuurstof om nikkelmonoxide te vormen.
Een andere methode omvat de oxidatie van metallisch nikkel. Metallisch nikkel kan bij hoge temperaturen reageren met zuurstof of lucht, waarbij nikkelmonoxide ontstaat. Voer dit proces uit door nikkelmetaal te calcineren of roosteren in een atmosfeer van lucht of zuurstof om nikkelmonoxide te produceren.
Gebruik precipitatiereacties om nikkelmonoxide te synthetiseren door nikkelzouten, zoals nikkelchloride of nikkelnitraat, te laten reageren met een alkalische oplossing zoals natriumhydroxide of ammoniumhydroxide . Deze reactie vormt een neerslag van nikkelmonoxide.
Sol-gelsynthese is een andere haalbare methode. Dit omvat de hydrolyse en condensatie van geschikte nikkelvoorlopers, zoals nikkelalkoxiden, in een oplossing. Verkrijg nikkelmonoxide door de tijdens de precipitatiereactie gevormde gel te drogen en te calcineren.
Gebruik elektrodepositietechnieken voor de synthese van nikkelmonoxide. Door een elektrische stroom aan te leggen op een nikkelelektrode die is ondergedompeld in een elektrolytoplossing, kan zich nikkelmonoxide vormen op het oppervlak van de elektrode.
Bij het kiezen van een synthesemethode moeten factoren zoals gewenste zuiverheid, schaalbaarheid en specifieke toepassingsvereisten in overweging worden genomen, aangezien elke methode zijn eigen voordelen biedt.
Gebruik van nikkel(ii)oxide
Nikkelmonoxide vindt vanwege zijn unieke eigenschappen verschillende toepassingen in verschillende industrieën. Hier zijn enkele van de meest voorkomende toepassingen:
- Katalysator: Nikkelmonoxide katalyseert actief verschillende chemische reacties, zoals hydrogenerings- en oxidatieprocessen, waardoor de omzetting van reactanten in gewenste producten wordt vergemakkelijkt.
- Keramiek: Bij de productie van keramische materialen fungeert nikkelmonoxide actief als kleurstof en draagt het actief bij aan het bereiken van specifieke kleuren en patronen in keramische glazuren en pigmenten.
- Batterijen: Oplaadbare nikkel-cadmium (NiCd) en nikkel-metaalhydride (NiMH) batterijen maken actief gebruik van nikkelmonoxide als positief elektrodemateriaal, waardoor de opslag en vrijgave van elektrische energie actief mogelijk wordt gemaakt.
- Gassensoren: Nikkelmonoxide detecteert actief gassen zoals koolmonoxide (CO) en stikstofdioxide (NO2) in gasdetectietoepassingen wanneer deze wordt gebruikt in daarop gebaseerde sensoren.
- Glasproductie: De glasindustrie maakt actief gebruik van nikkelmonoxide om verschillende kleuren aan glasproducten te geven, en draagt daarmee actief bij aan de productie van gekleurd glas, waaronder groene, bruine en zwarte tinten.
- Geleidende coatings: Nikkelmonoxide fungeert actief als onderdeel van geleidende coatings, waardoor materialen zoals glas of kunststoffen actief geleidend worden wanneer ze erop worden aangebracht.
- Brandstofcellen: Nikkelmonoxide functioneert actief als onderdeel van vaste-oxidebrandstofcellen (SOFC’s), werkt actief als kathodemateriaal en neemt deel aan elektrochemische reacties in de brandstofcel.
- Katalysatorondersteuning: Nikkelmonoxide dient actief als ondersteuningsmateriaal voor andere katalysatoren, waardoor hun stabiliteit en prestaties actief worden verbeterd.
De uiteenlopende toepassingen van nikkelmonoxide benadrukken het belang ervan in verschillende industrieën en benadrukken de bruikbaarheid en veelzijdigheid ervan.
Vragen:
Vraag: Wat is de formule voor nikkel(II)oxide?
A: De formule voor nikkel(II)oxide is NiO.
Vraag: Welk zout ontstaat wanneer nikkel(II)oxide reageert met salpeterzuur?
A: De reactie van nikkel(II)oxide met salpeterzuur vormt nikkel(II)nitraat (Ni(NO3)2).
Vraag: Bij welke spanning oxideert nikkel(II) tot nikkel(III)?
A: Nikkel(II) oxideert tot nikkel(III) bij een spanning van ongeveer +1,63V.
Vraag: Wat gebeurt er als Ni(s) wordt geoxideerd tot nikkel(II)-ionen, zoals weergegeven in de afbeelding?
A: Tijdens de oxidatie van Ni(s) tot nikkel(II)-ionen gaan elektronen verloren, wat resulteert in de vorming van Ni2+-ionen.
Vraag: Welke massa’s nikkel(II)oxide en aluminium moeten worden gebruikt om 13,3 g nikkel te produceren?
A: De massa’s nikkel(II)oxide en aluminium die nodig zijn om 13,3 g nikkel te produceren, zijn afhankelijk van de specifieke reactie en de betrokken stoichiometrie.
