Zilversulfaat (Ag2SO4) is een witte vaste stof die wordt gebruikt in de fotografie en analytische chemie. Het lost op in water en valt bij verhitting uiteen in zilveroxide en zwaveltrioxide.
| IUPAC-naam | Zilversulfaat |
| Moleculaire formule | Ag2SO4 |
| CAS-nummer | 10294-26-5 |
| Synoniemen | Zilversulfaat, zilversulfaat, zilverzwavelzuur, zilvermonosulfaat |
| InChi | InChI=1S/2Ag.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Eigenschappen van zilversulfaat
Zilversulfaatformule
De chemische formule voor diargentsulfaat is Ag2SO4. Het bestaat uit twee zilveratomen (Ag) gebonden aan één zwavelatoom (S) en vier zuurstofatomen (O). De formule vertegenwoordigt de verhouding van atomen in een molecuul diargentsulfaat.
Zilversulfaat Molaire Massa
De molaire massa van zilversulfaat wordt berekend door de atoommassa’s van de samenstellende elementen op te tellen. Zilver heeft een atoommassa van 107,87 gram per mol (g/mol), zwavel heeft een atoommassa van 32,07 g/mol en zuurstof heeft een atoommassa van 16,00 g/mol. Als je ze bij elkaar optelt, bedraagt de molaire massa van diargentsulfaat ongeveer 311,81 g/mol.
Kookpunt van zilversulfaat
Diargentsulfaat heeft geen duidelijk kookpunt omdat het ontleedt voordat het zijn kookpunt bereikt. Bij verhitting ondergaat het thermische ontleding en wordt het afgebroken tot zilveroxide (Ag2O) en zwaveltrioxide (SO3). Daarom is het kookpunt van diargentsulfaat niet van toepassing.
Zilversulfaat Smeltpunt
Het smeltpunt van diargentsulfaat is ongeveer 652 graden Celsius (1206 graden Fahrenheit). Bij deze temperatuur verandert diargentsulfaat van een vaste toestand naar een gesmolten vloeibare toestand. Het is belangrijk op te merken dat het smeltpunt enigszins kan variëren, afhankelijk van de zuiverheid van het diargentsulfaatmonster.
Dichtheid van zilversulfaat g/ml
De dichtheid van diargentsulfaat is ongeveer 5,45 gram per milliliter (g/ml). Deze waarde geeft de massa diargentsulfaat per volume-eenheid aan. De dichtheid van een stof hangt in het algemeen af van de temperatuur, dus het is belangrijk om rekening te houden met de omstandigheden bij het meten van de dichtheid van diargentsulfaat.
Zilversulfaat Molecuulgewicht
Het molecuulgewicht van diargentsulfaat wordt berekend door de atoomgewichten van de samenstellende elementen op te tellen, rekening houdend met de stoichiometrie van de formule. In het geval van zilversulfaat (Ag2SO4) bedraagt het molecuulgewicht ongeveer 311,81 gram per mol (g/mol).
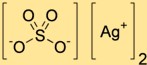
Structuur van zilversulfaat
Disilversulfaat heeft een kristalstructuur die bestaat uit zilverkationen (Ag+) en sulfaatanionen (SO4^2-). De zilverkationen zijn omgeven door zuurstofatomen van sulfaatanionen en vormen zo een driedimensionaal netwerk.
Oplosbaarheid van zilversulfaat
Diargentsulfaat is slecht oplosbaar in water. Het lost in beperkte mate op, waarbij ongeveer 0,8 gram oplost in 100 milliliter water bij kamertemperatuur. De oplosbaarheid kan worden beïnvloed door factoren zoals temperatuur en de aanwezigheid van andere opgeloste stoffen in de oplossing.
| Verschijning | Witte vaste stof |
| Soortelijk gewicht | N.v.t |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 311,81 g/mol |
| Dikte | 5,45 g/ml |
| Fusie punt | 652°C (1206°F) |
| Kookpunt | Ontbonden |
| Flitspunt | N.v.t |
| oplosbaarheid in water | Slecht oplosbaar |
| Oplosbaarheid | Lost op in water. zuren, alcoholen, aceton, ether, acetaten, amiden |
| Dampdruk | N.v.t |
| Dampdichtheid | N.v.t |
| pKa | N.v.t |
| pH | N.v.t |
Veiligheid en gevaren van zilversulfaat
Diargentsulfaat brengt enkele veiligheidsrisico’s met zich mee en voorzichtigheid is geboden bij het hanteren ervan. Het is belangrijk om inademing, inslikken of contact met huid en ogen te vermijden. Bij het hanteren van diagentsulfaat is het raadzaam om geschikte persoonlijke beschermingsmiddelen te dragen, waaronder handschoenen, een veiligheidsbril en een laboratoriumjas. In geval van accidentele blootstelling, spoel de getroffen gebieden grondig af met water. Diargentsulfaat kan huid- en oogirritatie veroorzaken, en langdurige of herhaalde blootstelling kan tot sensibilisatie leiden. Het is ook noodzakelijk om diargentsulfaat in een goed geventileerde ruimte te hanteren om het risico op inademing te minimaliseren. Om de veiligheid te garanderen, moeten de juiste opslag-, etiketterings- en verwijderingsprocedures worden gevolgd.
| Gevarensymbolen | Geen symbool |
| Beveiligingsbeschrijving | Vermijd inademing, inslikken en contact met huid en ogen. Draag PBM’s. Hanteren in een goed geventileerde ruimte. Correcte opslag, etikettering en verwijdering. |
| VN-identificatienummers | N.v.t |
| HS-code | 28429090 |
| Gevarenklasse | N.v.t |
| Verpakkingsgroep | N.v.t |
| Toxiciteit | Irriterend voor de huid en ogen. Langdurige/herhaalde blootstelling kan overgevoeligheid veroorzaken. |
Methoden voor de synthese van zilversulfaat
Er zijn verschillende methoden voor het synthetiseren van diargentsulfaat.
Een veelgebruikte methode is de reactie tussen zilvernitraat (AgNO3) en zwavelzuur (H2SO4) . In het laboratorium voegen wetenschappers, terwijl ze roeren, langzaam zilvernitraat toe aan een zwavelzuuroplossing, wat resulteert in de vorming van een wit neerslag dat diargentsulfaat wordt genoemd. Ze verzamelen het neerslag, wassen het en drogen het om zuiver diargentsulfaat te verkrijgen.
Wetenschappers verkrijgen ook zilversulfaat door zilveroxide (Ag2O) aan zwavelzuur toe te voegen en het mengsel al roerend te verwarmen. Dit proces produceert diargentsulfaat als neerslag, dat ze filteren, wassen en drogen om het eindproduct te verkrijgen.
Bovendien kunnen wetenschappers zilversulfaat verkrijgen door een mengsel van zilverchloride (AgCl) en geconcentreerd zwavelzuur te verwarmen. Ze voegen zilverchloride toe aan zwavelzuur en brengen warmte op het mengsel. De reactie leidt tot de vorming van zilversulfaat als neerslag, dat kan worden verzameld, gewassen en gedroogd.
Het is belangrijk op te merken dat deze synthesemethoden moeten worden uitgevoerd met passende veiligheidsmaatregelen, inclusief het gebruik van geschikte beschermende uitrusting en werken in een goed geventileerde ruimte.
Gebruik van zilversulfaat
Disilversulfaat heeft verschillende toepassingen op verschillende gebieden vanwege zijn unieke eigenschappen. Hier zijn enkele van de meest voorkomende toepassingen:
- Fotografie: Bij zwart-witfotografie gebruiken fotografen diargentsulfaat als onderdeel van lichtgevoelige emulsies om beelden vast te leggen en te ontwikkelen door te reageren met licht.
- Analytische chemie: Verschillende analytische methoden gebruiken zilversulfaat als reagens om halogeniden, zoals chloride- en bromide-ionen, te detecteren en te kwantificeren door middel van neerslagreacties.
- Galvaniseren: Bij galvaniseerprocessen wordt gebruik gemaakt van diargentsulfaat om een laag zilver op geleidende oppervlakken af te zetten, waardoor decoratieve of beschermende coatings op sieraden, elektronische apparaten en andere objecten ontstaan.
- Antimicrobieel middel: Vanwege zijn antimicrobiële eigenschappen vindt diargentsulfaat toepassing in de formulering van verbanden, zalven en medische hulpmiddelen. Het helpt infecties te voorkomen en bevordert de genezing.
- Batterij-industrie: De batterij-industrie gebruikt het als een cruciaal onderdeel van elektrodemateriaal voor de productie van zilver-zink- en zilver-cadmium-batterijen, die veel voorkomen in elektronische apparaten en medische apparatuur.
- Laboratoriumreagens: Disilversulfaat wordt gebruikt als reagens in een verscheidenheid aan laboratoriumexperimenten, waaronder de synthese van andere zilververbindingen en in organisch-chemische reacties.
- Glasproductie: Bij de glasproductie speelt het een cruciale rol bij de productie van speciaal glas, waaronder verzilverde spiegels en geleidende raamcoatings. Fabrikanten brengen een dunne laag diargentsulfaat aan om deze gewenste eigenschappen te bereiken.
- Katalysator: Dizilversulfaat fungeert als katalysator bij bepaalde chemische reacties, waaronder oxidatiereacties en polymerisatieprocessen.
Vragen:
Vraag: Wat wordt er nog meer geproduceerd bij de vervangingsreactie van zilvernitraat en kaliumsulfaat?
A: Bij de vervangingsreactie van AgNO3 en K2SO4 zijn de gevormde producten kaliumnitraat (KNO3) en diargentsulfaat (Ag2SO4).
Vraag: Zal het oplossen als er extra vast zilversulfaat aan de oplossing wordt toegevoegd?
A: Ja, extra vast zilversulfaat zal in de oplossing oplossen, omdat het slecht oplosbaar is in water.
Vraag: Vindt er neerslag plaats als zilvernitraat + natriumsulfaat?
A: Ja, er vindt neerslag plaats wanneer AgNO3 reageert met natriumsulfaat, wat resulteert in de vorming van een vast Ag2SO4-neerslag.
Vraag: Wat is het percentage zilver in zilversulfaat?
A: Het percentage Ag in diargentsulfaat is ongeveer 63,48%.
Vraag: Is zilversulfaat oplosbaar of onoplosbaar?
A: Diargentsulfaat is slecht oplosbaar in water.
Vraag: Hoe vind ik de chemische formule van zilversulfaat?
A: De chemische formule van zilversulfaat is Ag2SO4, die kan worden bepaald op basis van de valentie van het Ag+-kation en het SO4-2-anion.
Vraag: Wat is de kleur van Ag2SO4?
A: Dizilversulfaat (Ag2SO4) is een witte vaste stof.
Vraag: Wat is de Ksp-waarde voor Ag2SO4 als 5,49 g oplosbaar is in 1,00 liter water?
A: De waarde van de oplosbaarheidsproductconstante (Ksp) voor Ag2SO4 kan worden berekend met behulp van de verstrekte informatie, maar hiervoor zijn aanvullende gegevens nodig over de dissociatie van Ag2SO4 in water.
Vraag: Wat is de molaire massa van Ag2SO4?
A: De molaire massa van Ag2SO4 is ongeveer 311,81 g/mol.
Vraag: Wordt er een vaste Ag2SO4 gevormd wanneer 2,7 g wordt opgelost in 100 ml water?
A: Ja, er kan zich wat vast Ag2SO4 vormen als het de oplosbaarheidslimiet van diargentsulfaat in 100 ml water overschrijdt.
