Zinknitraat (Zn(NO3)2) is een verbinding die zink- en nitraationen bevat. Het is in water oplosbaar en wordt in de industrie vaak gebruikt voor verschillende toepassingen, onder meer als katalysator en bij de productie van kleurstoffen en pigmenten.
| IUPAC-naam | Zinknitraat |
| Moleculaire formule | Zn(NO3)2 |
| CAS-nummer | 7779-88-6 |
| Synoniemen | Zinkdinitraat, zinkzout van salpeterzuur, celloxaan, zinknitraat |
| InChi | InChI=1S/2NO3.Zn/c2 2-1(3)4;/q2 -1;+2 |
Eigenschappen van zinknitraat
Zinknitraatformule
De formule voor zinkdinitraat is Zn(NO3)2. Het bestaat uit één zinkion (Zn2+) en twee NO3-ionen, bij elkaar gehouden door ionische bindingen. De formule vertegenwoordigt de verhouding van de elementen die in de verbinding aanwezig zijn.
Zinknitraat molaire massa
De molaire massa van zinkdinitraat kan worden berekend door de atoommassa’s van de samenstellende elementen op te tellen. De atoommassa van zink (Zn) is ongeveer 65,38 gram per mol, en de atoommassa van stikstof (N) en zuurstof (O) in NO3-ionen is respectievelijk ongeveer 14,01 en 16,00 gram per mol. Daarom is de molmassa van zinkdinitraat ongeveer 189,38 gram per mol.
Kookpunt van zinknitraat
Zinkdinitraat heeft geen specifiek kookpunt, omdat het ontleedt voordat het zijn kookpunt bereikt. Bij verhitting valt het echter uiteen in zinkoxide, stikstofdioxide en zuurstof. Deze ontledingsreactie vindt plaats rond 140°C (284°F), waarbij bruine stikstofdioxidedampen vrijkomen.
Smeltpunt van zinknitraat
Het smeltpunt van zinkdinitraat hangt af van de hydratatietoestand. De watervrije vorm van zinkdinitraat (Zn(NO3)2) smelt bij ongeveer 238°C (460°F). De hexahydraatvorm (Zn(NO3)2·6H2O) heeft echter een lager smeltpunt van ongeveer 36°C (97°F) omdat het watermoleculen in zijn kristalstructuur bevat.
Dichtheid van zinknitraat g/ml
De dichtheid van zinkdinitraat varieert afhankelijk van de concentratie en temperatuur. Onder standaardomstandigheden is de dichtheid van de watervrije vorm echter ongeveer 2,065 gram per milliliter (g/ml). De dichtheid van de hexahydraatvorm is iets hoger vanwege de aanwezigheid van watermoleculen.
Zinknitraat Moleculair gewicht
Het molecuulgewicht van zinkdinitraat wordt berekend door de atoommassa’s van de samenstellende elementen op te tellen. Het molecuulgewicht van zinkdinitraat is ongeveer 189,38 gram per mol, zoals eerder vermeld.
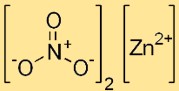
Structuur van zinknitraat
Zinkdinitraat heeft een ionische structuur, waarbij het zinkkation (Zn2+) omgeven is door zes watermoleculen in hexahydraatvorm. Nitraationen (NO3-) zijn als afzonderlijke entiteiten in het kristalrooster aanwezig.
Oplosbaarheid van zinknitraat
Zinkdinitraat is zeer oplosbaar in water. De oplosbaarheid neemt toe met de temperatuur. Bij kamertemperatuur kan ongeveer 118 gram zinkdinitraat oplossen in 100 gram water, wat resulteert in een verzadigde oplossing.
| Verschijning | Kleurloze kristallen |
| Soortelijk gewicht | 2.065 g/ml |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 189,38 g/mol |
| Dikte | 2.065 g/ml |
| Fusie punt | 238°C (460°F) (watervrij) |
| Kookpunt | Ontleedt (~140°C/284°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar in water |
| Oplosbaarheid | Oplosbaar in water |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet toepasbaar |
| pH | ~4 (waterige oplossing) |
Veiligheid en gevaren van zinknitraat
Zinkdinitraat brengt enkele veiligheidsrisico’s met zich mee waarmee rekening moet worden gehouden. Het is belangrijk om er voorzichtig mee om te gaan om mogelijke risico’s te voorkomen. Contact met de verbinding kan huid- en oogirritatie veroorzaken. Inslikken of inademen van zinkdinitraat kan maag-darmklachten en ademhalingsproblemen veroorzaken. Het is raadzaam om bij het werken met zinkdinitraat passende beschermende maatregelen te nemen, zoals handschoenen en een veiligheidsbril. Bovendien moet het worden opgeslagen in een goed geventileerde ruimte, uit de buurt van onverenigbare stoffen. In geval van accidentele blootstelling of inname wordt aanbevolen een arts te raadplegen. Het volgen van de juiste veiligheidsprotocollen garandeert een veilige omgang met en gebruik van zinkdinitraat.
| Gevarensymbolen | Oxidatiemiddel |
| Beveiligingsbeschrijving | Veroorzaakt huid- en oogirritatie. Vermijd inslikken en inademen. Hanteren met passende beschermende maatregelen. |
| VN-identificatienummers | UN-nr. 1514 (watervrij), UN-nr. 1515 (hexahydraat) |
| HS-code | 28342990 |
| Gevarenklasse | 5.1 (Oxiderende stoffen) |
| Verpakkingsgroep | II (watervrij), III (hexahydraat) |
| Toxiciteit | Matig giftig |
Zinknitraatsynthesemethoden
Er zijn verschillende methoden voor het synthetiseren van zinkdinitraat. Een gebruikelijke aanpak is de reactie tussen metallisch zink en salpeterzuur . Bij deze methode reageert zink met salpeterzuur om zinkdinitraat te produceren en waterstofgas vrij te maken. Operators controleren de reactie zorgvuldig om de veiligheid te behouden.
Een andere methode omvat de reactie tussen zinkoxide en salpeterzuur . Zinkoxide wordt opgelost in salpeterzuur, wat leidt tot de vorming van zinkdinitraat en water. Deze methode is nuttig wanneer zinkoxide direct beschikbaar is.
Bovendien kan zinkcarbonaat reageren met salpeterzuur om zinkdinitraat te produceren. Het carbonaat reageert met salpeterzuur en vormt kooldioxide, water en zinkdinitraat.
Het is belangrijk op te merken dat deze reacties moeten worden uitgevoerd onder geschikte laboratoriumomstandigheden en met de nodige veiligheidsmaatregelen. Er moeten geschikte beschermende uitrustingen worden gedragen, zoals handschoenen en een veiligheidsbril, en de reacties moeten worden uitgevoerd in een goed geventileerde ruimte.
Over het geheel genomen bieden deze methoden efficiënte manieren om zinkdinitraat te synthetiseren, waardoor het gebruik ervan in verschillende industriële toepassingen mogelijk wordt.
Gebruik van zinknitraat
Zinkdinitraat vindt toepassingen in verschillende industrieën vanwege zijn veelzijdige eigenschappen. Hier zijn enkele belangrijke toepassingen van zinkdinitraat:
- Katalysator: Zinkdinitraat katalyseert verschillende chemische reacties, waardoor de productie van kleurstoffen, farmaceutische producten en polymeren wordt vergemakkelijkt.
- Galvaniseren: Bij galvaniseerprocessen zet zinkdinitraat een laag zink af op metalen oppervlakken, waardoor corrosieweerstand wordt verkregen en het uiterlijk wordt verbeterd.
- Pigmenten en kleurstoffen: Zinkdinitraat fungeert als een voorloper bij de productie van pigmenten en kleurstoffen op zinkbasis, essentieel voor verven, coatings en textiel.
- Meststof: Zinkdinitraat dient als bron van zink in meststoffen en zorgt ervoor dat planten voldoende voedingsstoffen krijgen voor groei en ontwikkeling.
- Glasproductie: Zinkdinitraat speelt een belangrijke rol bij de glasproductie en verbetert de optische eigenschappen zoals transparantie en brekingsindex.
- Waterbehandeling: Zinkdinitraat speelt een essentiële rol in waterbehandelingssystemen, controleert de groei van algen en bacteriën en handhaaft de waterkwaliteit.
- Laboratoriumreagens: In verschillende laboratoriumexperimenten fungeert zinkdinitraat actief als reagens, vooral in de analytische chemie en onderzoek.
- Geneeskunde en farmaceutische producten: Zinkdinitraat draagt actief bij aan bepaalde farmaceutische formuleringen en plaatselijke medicatie vanwege de antimicrobiële eigenschappen.
- Vlamvertragers: Zinkdinitraat is een belangrijk onderdeel van vlamvertragende formuleringen, waardoor de ontvlambaarheid van materialen actief wordt verminderd.
- Textielindustrie: Bij het verven en bedrukken van textiel verbetert zinkdinitraat actief de kleurechtheid en verbetert de kleurabsorptie.
Deze uiteenlopende toepassingen benadrukken het belang van zinkdinitraat in meerdere industrieën en dragen bij aan een reeks producten en processen.
Vragen:
Vraag: Is zinknitraat oplosbaar?
A: Ja, zinkdinitraat is in water oplosbaar.
Vraag: Hoe kan ik zinkcarbonaat uit zinknitraat neerslaan?
A: Om zinkcarbonaat uit Zn(NO3)2 te laten neerslaan, voegt u natriumcarbonaat- of natriumbicarbonaatoplossing toe aan de zinkdinitraatoplossing, wat resulteert in de vorming van zinkcarbonaat als neerslag.
Vraag: Reageert zink met zilvernitraat?
A: Ja, Zn reageert met zilvernitraat, waarbij het metallisch zilver wordt verdrongen en zinkdinitraat wordt gevormd.
Vraag: Is zinknitraat een zout?
A: Ja, zinknitraat is een zout dat bestaat uit zinkkationen (Zn2+) en NO3-ionen.
Vraag: Wat ontstaat er als zinknitraat reageert met kaliumhydroxide?
A: Wanneer Zn(NO3)2 reageert met kaliumhydroxide, slaat Zn(OH)2 neer en wordt kaliumnitraat gevormd.
Vraag: Wat is de formule voor lithiumzinknitraat?
A: De formule voor lithiumzinkdinitraat is LiZn(NO3)3.
Vraag: Hoe standaardiseer ik magnesiumnitraat- en zinknitraatoplossingen?
A: Om magnesiumnitraat- en zink-dinitraatoplossingen te standaardiseren, kunnen titratiemethoden worden gebruikt met een geschikt gestandaardiseerd reagens.
Vraag: Wat zijn de zuur- en metaaloxides die worden gebruikt om zinknitraat te produceren?
A: Salpeterzuur (HNO3) en zinkoxide (ZnO) worden gebruikt om zinkdinitraat te produceren.
Vraag: Welke producten worden geproduceerd als zink wordt toegevoegd aan een loodnitraatoplossing?
A: Wanneer Zn wordt toegevoegd aan een oplossing van loodnitraat, worden zinkdinitraat en metallisch lood gevormd.
Vraag: Wat is zinknitraat?
A: Zinkdinitraat is een chemische verbinding bestaande uit zinkkationen (Zn2+) en NO3-anionen, vaak aangetroffen als een kristallijne vaste stof.
Vraag: Hoeveel zuurstofatomen zitten er in 1,50 mol Zn(NO3)2?
A: In 1,50 mol Zn(NO3)2 zitten 9,00 mol of 27,00 zuurstofatomen.
Vraag: Welke massa Zn(NO3)2 moet met H2O worden verdund tot een massa van 1,00 kg om 97 ppm Zn2+(aq) te bereiden?
A: Om een oplossing te bereiden die 97 ppm Zn2+(aq) bevat, moet ongeveer 97 mg Zn(NO3)2 worden verdund met water tot een massa van 1,00 kg.
