Natriumamide (NaNH2) is een chemische verbinding. Het bestaat uit natrium- en stikstofatomen. Het wordt gebruikt als een sterke base bij verschillende chemische reacties.
| IUPAC-naam | Natriumamide |
| Moleculaire formule | NaNH2 |
| CAS-nummer | 7782-92-5 |
| Synoniemen | Natriumamide, natriumazanide, natriumamide, natriumnitride |
| InChi | InChI=1S/NaN2/c2-1-3/q-1 |
Eigenschappen van natriumamide
Natriumamideformule
De formule voor natriumamide is NaNH2. Het bestaat uit een natriumatoom (Na), een waterstofatoom (H) en een stikstofatoom (N). Deze chemische formule vertegenwoordigt de samenstelling van natriumamide op moleculair niveau.
Natriumamide molaire massa
De molaire massa van natriumazanide wordt berekend door de atoommassa’s van de samenstellende elementen op te tellen. Natrium heeft een atoommassa van 22,99 gram per mol (g/mol) en stikstof heeft een atoommassa van 14,01 g/mol. Door deze waarden op te tellen, zien we dat de molaire massa van natriumazanide ongeveer 39 g/mol bedraagt.
Kookpunt van natriumamide
Het kookpunt van natriumazanide is de temperatuur waarbij het overgaat van een vloeistof naar een gas. Natriumazanide heeft een relatief hoog kookpunt van ongeveer 850 graden Celsius (°C). Bij deze temperatuur worden de intermoleculaire krachten die de natriumazanidemoleculen bij elkaar houden overwonnen, wat resulteert in de omzetting van de vloeibare naar de gasvormige toestand.
Natriumamide Smeltpunt
Het smeltpunt van natriumazanide is de temperatuur waarbij het overgaat van vast naar vloeibaar. Natriumazanide heeft een relatief laag smeltpunt van ongeveer 210 graden Celsius (°C). Bij deze temperatuur wordt de kristalroosterstructuur van vast natriumazanide afgebroken, waardoor de deeltjes vrij kunnen bewegen en een vloeistof vormen.
Dichtheid van natriumamide g/ml
De dichtheid van natriumazanide is een maat voor de massa per volume-eenheid. De dichtheid van natriumazanide is ongeveer 1,39 gram per milliliter (g/ml). Deze waarde geeft aan dat natriumazanide een relatief dichte stof is.
Natriumamide Molecuulgewicht
Het molecuulgewicht van natriumazanide is de som van de atoomgewichten van alle atomen in de chemische formule. Het molecuulgewicht van natriumazanide is ongeveer 39 gram per mol (g/mol).
Structuur van natriumamide
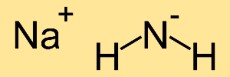
De structuur van natriumazanide bestaat uit één natriumatoom (Na) gebonden aan twee stikstofatomen (N). De stikstofatomen vormen een lineaire opstelling met het natriumatoom in het midden, wat resulteert in een lineaire moleculaire structuur.
Oplosbaarheid van natriumamide
Natriumazanide is slecht oplosbaar in water. Het reageert met water en vormt natriumhydroxide (NaOH) en ammoniak (NH3). Het is echter oplosbaar in sommige organische oplosmiddelen zoals vloeibare ammoniak en vloeibare alcoholen. De oplosbaarheid van natriumazanide in deze oplosmiddelen maakt het gebruik ervan in verschillende chemische reacties mogelijk.
| Verschijning | Witte vaste stof |
| Soortelijk gewicht | 1,39 g/ml |
| Kleur | Wit |
| Geur | Vergelijkbaar met ammoniak |
| Molaire massa | 39 g/mol |
| Dikte | 1,39 g/ml |
| Fusie punt | 210°C |
| Kookpunt | 850°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Reageert |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen zoals vloeibare ammoniak en vloeibare alcoholen |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Alkalisch (meer dan 7) |
Veiligheid en gevaren van natriumamide
Natriumazanide brengt bepaalde veiligheidsrisico’s en gevaren met zich mee waarmee rekening moet worden gehouden. Het reageert heftig met water, waarbij giftig ammoniakgas en corrosief natriumhydroxide vrijkomen. Daarom moet er uiterst voorzichtig mee worden omgegaan om contact met vocht of water te vermijden. Natriumazanide is ook een sterke base, die ernstige brandwonden en oogletsel kan veroorzaken als het in contact komt met de huid of ogen. Inademing van stof of dampen kan de luchtwegen irriteren. Het is raadzaam om geschikte beschermende uitrusting te dragen, zoals handschoenen, een veiligheidsbril en een gasmasker, wanneer u met natriumazanide werkt. Adequate ventilatie en opslag uit de buurt van onverenigbare stoffen zijn essentiële veiligheidsmaatregelen.
| Gevarensymbolen | Bijtend, schadelijk, giftig |
| Beveiligingsbeschrijving | Ga uiterst voorzichtig te werk. Vermijd contact met water/vocht. Draag beschermende uitrusting. Voldoende ventilatie en opslag zijn vereist. |
| VN-identificatienummers | VN 1410 |
| HS-code | 28500020 |
| Gevarenklasse | 4.3 (Gevaarlijk bij nat), 6.1 (Giftig), 8 (Bijtend) |
| Verpakkingsgroep | II |
| Toxiciteit | Giftig bij inslikken, inademen of huid-/oogcontact |
Methoden voor de synthese van natriumamide
Er zijn verschillende methoden voor het synthetiseren van natriumazanide.
Een veelgebruikte methode is de reactie tussen metallisch natrium en gasvormig ammoniak (NH3) . Bij dit proces reageert natriummetaal onder gecontroleerde omstandigheden met ammoniakgas om natriumazanide te produceren. De reactie vindt doorgaans plaats in een reactorvat dat is uitgerust met passende veiligheidsmaatregelen.
Een andere methode omvat de reactie tussen natriumhydride (NaH) en ammoniakgas . Natriumhydride, een vaste verbinding, reageert met ammoniakgas en produceert natriumazanide en waterstofgas. Om deze reactie uit te voeren worden vaak inerte atmosferen gebruikt om ongewenste nevenreacties te voorkomen.
Bovendien maakt de reactie tussen metallisch natrium en vloeibare ammoniak de bereiding van natriumazanide mogelijk. Deze methode omvat het oplossen van natriummetaal in vloeibare ammoniak , wat resulteert in de vorming van natriumazanide en waterstofgas.
Om natriumazide te synthetiseren, reageert natriumazide (NaN3) met natriumhydroxide (NaOH). De reactie tussen deze twee verbindingen produceert natriumazanide en het vrijkomen van stikstofgas.
Opgemerkt moet worden dat deze synthetische methoden expertise en passende veiligheidsmaatregelen vereisen vanwege de reactiviteit en gevaren die met natriumazanide gepaard gaan.
Gebruik van natriumamide
Natriumazanide vindt vanwege zijn unieke eigenschappen toepassingen op verschillende gebieden. Hier zijn enkele toepassingen:
- Sterke basis in organisch-chemische reacties: Natriumazanide deprotoneert zwakke zuren, waardoor de synthese van verschillende organische verbindingen wordt vergemakkelijkt.
- Bron van stikstof in reacties: Natriumazanide introduceert stikstofatomen in organische moleculen en speelt een cruciale rol bij de synthese van farmaceutische producten, kleurstoffen en polymeren.
- Dehydrohalogenering: Natriumazanide verwijdert waterstofhalogeniden uit organische verbindingen bij dehydrohalogeneringsreacties. Dit proces vergemakkelijkt de bereiding van alkenen, alkynen en andere onverzadigde verbindingen.
- Ringopeningsreacties: Natriumazanide neemt deel aan ringopeningsreacties van cyclische verbindingen, zoals de Gabriel-synthese, waarbij cyclische aminen worden omgezet in primaire aminen.
- Ontzwaveling: Natriumazanide kan zwavelatomen uit organische verbindingen verwijderen, waardoor ontzwavelingsreacties mogelijk worden. Dit is nuttig bij de productie van zwavelvrije brandstoffen en bij het verminderen van de milieueffecten van zwavelhoudende verbindingen.
- Waterstofopslag: Onderzoekers onderzochten het potentiële gebruik van natriumazanide in waterstofopslagsystemen. Het kan reageren met waterstofgas, waarbij natriumhydride ontstaat, dat bij verhitting waterstof kan afgeven.
- Katalysatorondersteuning: Natriumazanide kan fungeren als katalysatorondersteuning, waardoor de prestaties van bepaalde katalytische reacties worden verbeterd. Het zorgt voor de stabiliteit en verbetert de efficiëntie van katalysatoren bij verschillende chemische transformaties.
Over het geheel genomen maken de veelzijdige eigenschappen van natriumazanide het tot een waardevolle verbinding in de organische synthese, stikstofchemie en andere industriële toepassingen.
Vragen:
Vraag: Wat doet NaNH2?
A: NaNH2 is een sterke base die vaak wordt gebruikt in organisch-chemische reacties om zwakke zuren te deprotoneren en verschillende transformaties te vergemakkelijken.
Vraag: Wat is NaNH2?
A: NaNH2 is natriumamide, een chemische verbinding bestaande uit natrium- (Na) en azanide-ionen (NH2), vaak gebruikt als reagens en sterke base bij organische synthese.
Vraag: Waar wordt overmatig NaNH2 voor gebruikt?
A: Een teveel aan NaNH2 kan leiden tot extra deprotonering van zure waterstofatomen in een reactie, waardoor de mate van deprotonering toeneemt en mogelijk de uitkomst van de reactie verandert.
Vraag: Wat doet NaNH2 met een alkeen?
A: NaNH2 kan een waterstofatoom uit een alkeen extraheren, wat resulteert in de vorming van een alkaan en een natriumalkoxideverbinding.
Vraag: Wat doet NaNH2 met broombenzeen?
A: NaNH2 kan het broomatoom in broombenzeen vervangen via een nucleofiele substitutiereactie, resulterend in de vorming van natriumfenylamine.
Vraag: Is NaNH2 een sterke base?
A: Ja, NaNH2 is een sterke base die in staat is protonen te accepteren en zwakke zuren te deprotoneren vanwege de aanwezigheid van het amide-ion.
Vraag: Welke reactie zal plaatsvinden als H2O wordt toegevoegd aan een NaNH2/NH3-mengsel?
A: Het toevoegen van H2O aan een NaNH2/NH3-mengsel resulteert in de vorming van ammoniakgas (NH3) en natriumhydroxide (NaOH) als gevolg van de reactie tussen water en de sterke base NaNH2.
Vraag: Welk tussenproduct is bij deze reactie betrokken: NaNH2 + vloeibare NH3?
A: Het tussenproduct dat betrokken is bij de reactie van NaNH2 met vloeibare NH3 is een gesolvateerd elektron, gevormd door de donatie van een elektron van natrium aan ammoniak.
Vraag: Is NaNH2 een goed nucleofiel?
A: Ja, NaNH2 kan fungeren als een goed nucleofiel vanwege zijn vermogen om een elektronenpaar te doneren en deel te nemen aan nucleofiele substitutiereacties.
Vraag: Is NaNH2 ionisch of covalent?
A: NaNH2 is een ionische verbinding bestaande uit positief geladen natriumionen (Na+) en negatief geladen amide-ionen (NH2-).
Vraag: Zal 2-hexyne reageren met natriumamide?
A: Ja, 2-hexyn kan reageren met natriumamide, wat resulteert in de vorming van natriumacetylide en de overeenkomstige alkynverbinding.
Vraag: Wat is de sterkste base onder natriumamide en natriumfenoxaat?
A: Natriumazanide is de sterkere base dan natriumfenoxaat vanwege de grotere basiciteit van het amide-ion (NH2-) vergeleken met het fenox-ion (C6H5O-).
