Fosforoxychloride (POCl3) is een chemische verbinding die in verschillende industriële processen wordt gebruikt. Het reageert met water en vormt fosforzuur en zoutzuur.
| IUPAC-naam | Fosforoxychloride |
| Moleculaire formule | POCl3 |
| CAS-nummer | 10025-87-3 |
| Synoniemen | Fosforylchloride, fosforyltrichloride, fosfortrichloride |
| InChi | InChI=1S/Cl3OP/c1-4(2)3 |
Eigenschappen van fosforoxychloride
Fosforoxychloride-formule
De chemische formule voor fosforylchloride is POCl3. Het bestaat uit één fosforatoom (P), gesymboliseerd door P, en drie chlooratomen (Cl), gesymboliseerd door Cl. De formule geeft de verhouding aan van elk element dat in de verbinding aanwezig is.
Fosforoxychloride Molaire massa
De molaire massa van fosforylchloride kan worden berekend door de atoommassa’s van de samenstellende elementen op te tellen. Fosfor heeft een molaire massa van 30,97 g/mol, terwijl chloor een molaire massa heeft van 35,45 g/mol. Door de molaire massa van chloor met 3 te vermenigvuldigen en de molaire massa van fosfor toe te voegen, ontstaat een totale molaire massa van ongeveer 153,33 g/mol voor fosforylchloride.
Kookpunt van fosforoxychloride
Fosforylchloride heeft een kookpunt van ongeveer 105,5°C. Deze temperatuur vertegenwoordigt het punt waarop de vloeibare verbinding onder standaard atmosferische druk in de gasvormige toestand verandert. Kookpunt is een belangrijk kenmerk dat de hantering en toepassing van fosforylchloride beïnvloedt.
Fosforoxychloride Smeltpunt
Het smeltpunt van fosforylchloride is ongeveer -112,5°C. Dit betekent de temperatuur waarbij de vaste verbinding overgaat in de vloeibare toestand. Het smeltpunt is een kritische parameter bij opslag- en transportoverwegingen.
Dichtheid van fosforoxychloride g/ml
De dichtheid van fosforylchloride is ongeveer 1,65 g/ml. Dichtheid verwijst naar de hoeveelheid massa per volume-eenheid van een stof. Een hogere dichtheid suggereert een grotere concentratie van deeltjes in een bepaald volume.
Fosforoxychloride Molecuulgewicht
Het molecuulgewicht van fosforylchloride wordt berekend door de atoommassa’s van de samenstellende elementen op te tellen. Het molecuulgewicht van fosfor is ongeveer 30,97 g/mol, terwijl chloor een molecuulgewicht heeft van 35,45 g/mol. Het toevoegen van de gewogen massa’s levert een benaderd molecuulgewicht op van 153,33 g/mol voor fosforylchloride.
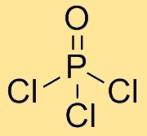
Structuur van fosforoxychloride
Fosforylchloride heeft een moleculaire structuur waarin één fosforatoom gebonden is aan drie chlooratomen en één zuurstofatoom. De chlooratomen zijn symmetrisch rond het centrale fosforatoom gerangschikt, waarbij het zuurstofatoom ook aan het fosforatoom is gebonden. Deze opstelling vormt een tetraëdrische geometrie.
Oplosbaarheid van fosforoxychloride
Fosforylchloride is slecht oplosbaar in water, maar lost gemakkelijk op in organische oplosmiddelen zoals benzeen, tetrachloorkoolstof en chloroform. Het oplosbaarheidsgedrag wordt toegeschreven aan de polaire aard van het molecuul en de aanwezigheid van elektronegatieve atomen zoals zuurstof en chloor.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 1.645 g/ml |
| Kleur | Kleurloos |
| Geur | Akko |
| Molaire massa | 153,33 g/mol |
| Dikte | 1.645 g/ml |
| Fusie punt | -112,5°C |
| Kookpunt | 105,5°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Reageert heftig |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen zoals benzeen, tetrachloorkoolstof en chloroform |
| Dampdruk | 11 mmHg bij 20°C |
| Dampdichtheid | 5,29 (Lucht = 1) |
| pKa | Niet toepasbaar |
| pH | Niet toepasbaar |
Veiligheid en gevaren van fosforoxychloride
Fosforylchloride brengt veiligheidsrisico’s met zich mee en vereist een zorgvuldige omgang. Het is bijtend voor de huid, ogen en luchtwegen. Contact kan ernstige brandwonden en oogletsel veroorzaken. Inademing van de dampen of dampen ervan kan de luchtwegen irriteren. Bij het werken met dit middel moeten geschikte persoonlijke beschermingsmiddelen, zoals handschoenen en een veiligheidsbril, worden gedragen. Het moet worden opgeslagen in een goed geventileerde ruimte, uit de buurt van ontstekingsbronnen. Bij blootstelling is onmiddellijke medische aandacht noodzakelijk. Bovendien moet het onder een zuurkast worden gehanteerd om het vrijkomen van giftige dampen te voorkomen.
| Gevarensymbolen | Bijtend, gevaar |
| Beveiligingsbeschrijving | Bijtend. Veroorzaakt ernstige brandwonden en oogletsel. Kan schadelijk zijn bij inademing of inslikken. Vermijd contact en inademing. |
| VN-identificatienummers | Een 1810 |
| HS-code | 2812.10.00 |
| Gevarenklasse | Klasse 8 (bijtende stoffen) |
| Verpakkingsgroep | Verpakkingsgroep III (klein gevaar) |
| Toxiciteit | Fosforylchloride is giftig en kan ernstige gevolgen voor de gezondheid veroorzaken. |
Methoden voor de synthese van fosforoxychloride
Fosforylchloride kan op verschillende manieren worden gesynthetiseerd. Een veelgebruikte methode is de reactie tussen fosfortrichloride (PCl3) en zuurstof (O2). Bij dit proces wordt PC13 verwarmd in aanwezigheid van een overmaat zuurstof om fosforylchloride te vormen. De reactie is exotherm en vindt gewoonlijk plaats in een gecontroleerde omgeving, zoals een reactorvat.
Een andere synthesemethode omvat de reactie tussen fosforpentoxide (P2O5) en fosfortrichloride. P2O5 werkt als dehydraterend middel en vormt in combinatie met PCl3 fosforylchloride.
Bovendien kan fosforylchloride worden gesynthetiseerd door de reactie van fosfortribromide (PBr3) en fosforpentoxide. Deze reactie leidt tot de vorming van fosforylchloride en fosforpentabromide.
Bovendien kan directe chlorering van fosfor ook fosforylchloride produceren. Bij dit proces stroomt chloorgas over verwarmde fosfor, wat resulteert in de vorming van fosforylchloride.
Het is belangrijk op te merken dat deze synthetische methoden met voorzichtigheid moeten worden uitgevoerd vanwege de reactiviteit en de gevaarlijke aard van de betrokken verbindingen. De juiste veiligheidsprotocollen, inclusief het gebruik van beschermende uitrusting en gecontroleerde reactieomstandigheden, moeten worden gevolgd om een veilige omgang met en synthese van fosforylchloride te garanderen.
Gebruik van fosforoxychloride
Fosforylchloride vindt vanwege zijn unieke eigenschappen verschillende toepassingen in verschillende industrieën. Hier zijn enkele veelvoorkomende toepassingen:
- Chemische synthese: De organische chemie maakt op grote schaal gebruik van fosforylchloride als een veelzijdig reagens om verschillende verbindingen te produceren, waaronder fosfonzuren, esters en amiden.
- Agrochemicaliën: Bij de synthese van pesticiden en herbiciden bij gewasbescherming en ongediertebestrijding is fosforylchloride een sleutelingrediënt, dat een cruciale rol speelt.
- Farmaceutische industrie: Bij de productie van farmaceutische tussenproducten en actieve farmaceutische ingrediënten (API’s) wordt gebruik gemaakt van fosforylchloride, wat de synthese van belangrijke medicijnen zoals antimalaria- en ontstekingsremmende medicijnen vergemakkelijkt.
- Polymeerindustrie: Bij de productie van polymeren fungeert fosforylchloride als katalysator en chloreringsmiddel en draagt het bij aan de synthese van vlamvertragende additieven die de brandwerendheid van materialen verbeteren.
- Vervaardiging van kleurstoffen en pigmenten: Fosforylchloride vindt toepassing bij de productie van kleurstoffen en pigmenten, vooral bij de bereiding van chlooralkylfosfonaten, verbindingen die essentieel zijn voor de ontwikkeling van kleurstoffen die worden gebruikt in textiel, inkten en coatings.
- Laboratoriumreagens: Bij verschillende laboratoriumprocedures wordt fosforylchloride als reagens gebruikt, waaronder de omzetting van alcoholen in alkylchloriden en de bereiding van fosforylerende middelen.
- Waterbehandeling: Bij waterbehandelingsprocessen wordt fosforylchloride gebruikt als verzurend en desinfecterend middel om de pH-waarde onder controle te houden en onzuiverheden te verwijderen.
- Vlamvertragers: Fosforylchloride speelt een rol bij de productie van vlamvertragende materialen en verbetert de brandveiligheidseigenschappen van textiel, kunststoffen en bouwmaterialen.
Deze uiteenlopende toepassingen tonen het belang van fosforylchloride in veel industriële sectoren aan, en benadrukken de cruciale rol ervan in de chemische synthese, landbouw, farmaceutische industrie en materiaalkunde.
Vragen
Vraag: Wat is de moleculaire geometrie van POCl3?
A: De moleculaire geometrie van POCl3 is trigonaal piramidaal.
Vraag: Wat is het belangrijkste alkeen dat wordt gevormd wanneer verbinding A wordt gedehydrateerd met POCl3 en pyridine?
A: Het belangrijkste alkeen dat wordt gevormd tijdens de dehydratatie van verbinding A met POCl3 en pyridine hangt af van de specifieke structuur van verbinding A.
Vraag: Is POCl3 polair of niet-polair
A: POCl3 is een polair molecuul vanwege de aanwezigheid van polaire bindingen en een asymmetrische moleculaire vorm.
Vraag: Hoeveel POCl3-gas kan er worden geproduceerd?
A: Het geproduceerde volume POCl3-gas hangt af van de hoeveelheden reactanten en de specifieke reactieomstandigheden.
Vraag: Hoeveel mol POCl3 zit er in 10,0 gram POCl3?
A: Er zit ongeveer 0,082 mol POCl3 in 10,0 gram POCl3.
Vraag: Wat is de elektronenpaargeometrie voor P in POCl3?
A: De elektronenpaargeometrie voor P in POCl3 is tetraëdrisch.
Vraag: Heeft POCl3 een dipoolmoment?
A: Ja, POCl3 heeft een dipoolmoment vanwege de aanwezigheid van polaire bindingen en de moleculaire geometrie ervan.
Vraag: Heeft POCl3 resonantie?
A: Nee, POCl3 vertoont geen resonantie omdat er geen gedelokaliseerde elektronen of meervoudige resonantiestructuren zijn.
Vraag: Wat is de geometrie van het elektronische domein rond het zuurstofatoom in POCl3?
A: De geometrie van het elektronische domein rond het zuurstofatoom in POCl3 is trigonaal piramidaal.
Vraag: Welk volume H3PO4 zal zich vormen als 72,3 milliliter POCl3 volledig reageert?
A: Het volume H3PO4 dat wordt gevormd wanneer 72,3 milliliter POCl3 reageert, hangt volledig af van de stoichiometrie van de reactie en kan niet worden bepaald op basis van alleen de verstrekte informatie.
