Sulfurylchloride (SO2Cl2) is een verbinding die wordt gevormd door de combinatie van zwaveldioxide en chloor. Het wordt gebruikt als reagens bij chemische reacties en als ontsmettingsmiddel om ongedierte te bestrijden.
| IUPAC-naam | Sulfurylchloride |
| Moleculaire formule | SO2Cl2 |
| CAS-nummer | 7791-25-5 |
| Synoniemen | Zwaveldichloride, Zwaveloxychloride, Zwaveldichlorideoxide |
| InChi | InChI=1S/Cl2O2S/c1-5(2)6(3)4 |
Eigenschappen van zwavelylchloride
Sulfurylchloride-formule
De chemische formule voor zwavelzuurdichloride is SO2Cl2. Het is afgeleid van de combinatie van één zwavelatoom, twee zuurstofatomen en twee chlooratomen. Deze formule vertegenwoordigt de samenstelling en rangschikking van atomen in een zwavelzuurdichloridemolecuul.
Sulfurylchloride molaire massa
De molaire massa van zwavelzuurdichloride kan worden berekend door de atoommassa’s van de samenstellende elementen op te tellen. Zwaveldichloride heeft een molaire massa van ongeveer 134,97 gram per mol. Deze waarde is belangrijk voor verschillende berekeningen van chemische reacties en stoichiometrie.
Kookpunt van sulfidechloride
Zwaveldichloride heeft een kookpunt van ongeveer 69 graden Celsius. Wanneer de temperatuur boven dit punt stijgt, ondergaat zwaveldichloride een faseverandering, waarbij het verandert van een vloeistof in een gas. Het kookpunt is een cruciale parameter bij het bepalen van de omstandigheden waaronder zwavelzuurdichloride kan worden gebruikt of verwerkt.
Smeltpunt van Sulfurylchloride
Het smeltpunt van zwavelzuurdichloride is ongeveer -54 graden Celsius. Bij temperaturen onder dit punt verandert zwavelzuurdichloride van een vaste naar een vloeibare toestand. Het smeltpunt is belangrijk voor de opslag en hantering van zwavelzuurdichloride, omdat het de omstandigheden aangeeft waaronder het stolt of vloeibaar wordt.
Dichtheid van zwavelylchloride g/ml
De dichtheid van zwavelzuurdichloride is ongeveer 1,638 gram per milliliter (g/ml). De dichtheid vertegenwoordigt de massa van een stof per volume-eenheid en helpt bij het bepalen van het fysieke gedrag ervan. De dichtheid van zwavelzuurdichloride is belangrijk voor het begrijpen van het drijfvermogen, de oplosbaarheid en de compatibiliteit ervan met andere stoffen.
Sulfurylchloride Molecuulgewicht
Het molecuulgewicht van zwavelzuurdichloride is ongeveer 134,97 atomaire massa-eenheden (u). Het is de som van de atoommassa’s van de samenstellende atomen van een molecuul zwaveldichloride. Het molecuulgewicht levert cruciale informatie voor verschillende chemische berekeningen en voor het bepalen van de hoeveelheid stof in een bepaald monster.
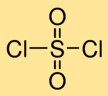
Structuur van zwavelylchloride
Zwaveldichloride heeft een moleculaire structuur waarin één zwavelatoom dubbel gebonden is aan twee zuurstofatomen en enkelvoudig gebonden aan twee chlooratomen. Deze opstelling vormt een centraal zwavelatoom omgeven door zuurstof- en chlooratomen, waardoor zwavelzuurdichloride zijn karakteristieke structuur krijgt.
Oplosbaarheid van sulfidechloride
Zwaveldichloride is slecht oplosbaar in water. Het reageert met water en produceert zoutzuur en zwavelzuur, waardoor het hydrolytisch reactief wordt. Zwaveldichloride vertoont echter enige oplosbaarheid in organische oplosmiddelen zoals gechloreerde koolwaterstoffen en aromatische verbindingen, waardoor ze geschikt zijn voor bepaalde toepassingen.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 1.638 g/ml |
| Kleur | N.v.t |
| Geur | Scherp, verstikkend |
| Molaire massa | 134,97 g/mol |
| Dikte | 1.638 g/ml |
| Fusie punt | -54°C |
| Kookpunt | 69°C |
| Flitspunt | N.v.t |
| oplosbaarheid in water | Reageert heftig |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen zoals gechloreerde koolwaterstoffen en aromatische verbindingen |
| Dampdruk | 43,6 mmHg (bij 25°C) |
| Dampdichtheid | 4,43 (lucht = 1) |
| pKa | N.v.t |
| pH | N.v.t |
Veiligheid en gevaren van sulfurylchloride
Zwaveldichloride brengt verschillende veiligheidsrisico’s met zich mee en er moeten voorzorgsmaatregelen worden genomen bij de omgang ermee. Het is een bijtende stof die bij contact ernstige brandwonden aan de huid, ogen en luchtwegen kan veroorzaken. Directe inademing van de dampen kan irritatie van de luchtwegen en longschade veroorzaken. Het reageert hevig met water, waarbij giftige gassen vrijkomen en explosiegevaar ontstaat. Daarom is het belangrijk om zwavelzuurdichloride te hanteren in een goed geventileerde ruimte en om geschikte beschermende uitrusting te dragen, zoals handschoenen, een veiligheidsbril en ademhalingsbescherming. Gemorst materiaal moet onmiddellijk worden opgeruimd met behulp van de juiste procedures en worden opgeslagen op een koele, droge plaats, uit de buurt van onverenigbare materialen.
| Gevarensymbolen | Corrosief (C), Oxiderend (O) |
| Beveiligingsbeschrijving | Veroorzaakt ernstige brandwonden en oogletsel. Reageert hevig met water. |
| VN-identificatienummers | UN 1834 (Zwaveldichloride) |
| HS-code | 28121000 |
| Gevarenklasse | 8 (Bijtende stoffen) |
| Verpakkingsgroep | II (Gemiddeld gevaar) |
| Toxiciteit | Zeer giftig; Schadelijk bij inslikken, inademen of opname via de huid. |
Methoden voor de synthese van zwavelylchloride
Mensen gebruiken gewoonlijk een paar methoden om zwavelzuurdichloride te synthetiseren.
Eén methode omvat de reactie tussen zwaveldioxide (SO2) en chloorgas (Cl2) . In aanwezigheid van een katalysator, zoals actieve kool of aluminiumchloride, reageren de gassen om zwavelzuurdichloride (SO2Cl2) te vormen. Deze reactie vindt doorgaans plaats bij hoge temperaturen, rond de 100 tot 200°C.
Een andere methode voor het synthetiseren van zwavelzuurdichloride omvat de reactie van zwaveltrioxide (SO3) met waterstofchloride (HCl). Onder gecontroleerde omstandigheden combineren deze twee verbindingen om zwavelzuurdichloride te produceren. Deze reactie is exotherm en vindt doorgaans plaats in de gasfase.
Het thionylchlorideproces genereert zwavelzuurdichloride door de reactie op kamertemperatuur van zwavelzuur (H2SO4) met fosforpentachloride (PCl5) . Bij deze reactie ontstaat zwaveldichloride en bijproducten zoals fosforzuur (H3PO4) en waterstofchloride (HCl). Industriële omgevingen gebruiken deze methode vaak.
Het is belangrijk op te merken dat deze synthesemethoden een zorgvuldige omgang met reagentia en het in acht nemen van veiligheidsmaatregelen vereisen vanwege de reactiviteit en de gevaarlijke aard van de betrokken stoffen.
Bovendien gebruiken scheikundigen vaak geschikte apparatuur, zoals condensors en refluxsystemen, om de reactieomstandigheden te controleren en een succesvolle synthese van zwavelzuurdichloride te garanderen.
Gebruik van Sulfurylchloride
Zwaveldichloride (SO2Cl2) vindt vanwege zijn unieke eigenschappen verschillende toepassingen in verschillende industrieën. Hier zijn enkele belangrijke toepassingen van zwavelzuurdichloride:
- Chemisch reagens: Bij de organische synthese wordt doorgaans zwavelzuurdichloride gebruikt als een veelzijdig chemisch reagens, waar het actief deelneemt aan verschillende reacties, waaronder chlorering, sulfonering en verestering, waardoor de introductie van chloor-, zwavel- of zuurfunctionaliteiten in organische verbindingen mogelijk wordt.
- Pesticide en ontsmettingsmiddel: Zwaveldichloride werkt als een krachtig ontsmettingsmiddel om ongedierte in opgeslagen graan, meelfabrieken en voedselverwerkingsfaciliteiten te bestrijden, waarbij actief insecten, larven en ongedierte worden geëlimineerd die landbouwproducten kunnen beschadigen die zijn opgeslagen vanwege de sterke biocide eigenschappen.
- Polymerisatie: Bij de polymerisatie van specifieke monomeren, zoals vinylchloride, dient zwavelzuurdichloride als een actieve katalysator of initiator, waardoor de productie van polyvinylchloride (PVC) wordt vergemakkelijkt, een veelgebruikt thermoplastisch polymeer met toepassingen in de bouw-, auto- en elektriciteitsindustrie.
- Farmaceutische producten: Zwaveldichloride speelt actief een cruciale rol bij de synthese van farmaceutische verbindingen, vooral sulfonamiden, essentiële antibiotica en therapeutische middelen die worden gebruikt om verschillende infecties te behandelen.
- Vervaardiging van kleurstoffen: Zwaveldichloride neemt actief deel aan de productie van kleurstoffen, vooral die welke zwavel of chloor bevatten. Het introduceert actief gewenste functionele groepen en verbetert de kleurechtheid en kleurstabiliteit.
- Chemische tussenproducten: Zwaveldichloride dient als een actief tussenproduct bij de synthese van andere chemicaliën, waaronder zwaveldioxide, zwavelzuur en sulfonylchloriden, die toepassingen vinden in veel industrieën, zoals de productie van wasmiddelen, de productie van kunststoffen en de farmaceutische industrie.
- Waterbehandeling: Voor waterzuivering en desinfectie neutraliseert en elimineert zwavelzuurdichloride actief schadelijke bacteriën, virussen en andere micro-organismen die aanwezig zijn in waterbronnen.
- Laboratoriumtoepassingen: Diverse laboratoriumprocedures maken actief gebruik van zwavelzuurdichloride, bijvoorbeeld voor de detectie en bepaling van primaire en secundaire aminen. Het reageert actief met aminen om stabiele sulfonamiden te vormen, waardoor de analyse en karakterisering ervan wordt vergemakkelijkt.
Vragen:
Vraag: Wat is het totale aantal grammoleculen SO2Cl2 in 13,5 g sulfidechloride?
A: Het totale aantal grammoleculen SO2Cl2 in 13,5 g sulfidechloride kan worden berekend door de gegeven massa te delen door de molaire massa SO2Cl2.
Vraag: Is SO2Cl2 polair of niet-polair?
A: SO2Cl2 is een polair molecuul vanwege de aanwezigheid van polaire bindingen en een asymmetrische moleculaire geometrie.
Vraag: Wanneer zal de SO2Cl2-druk afnemen?
A: De drukval van SO2Cl2 hangt af van verschillende factoren, zoals temperatuur, volume en reactieomstandigheden. Dit kan niet alleen op basis van tijd worden bepaald.
Vraag: Wat is de partiële druk van SO2Cl2 in dit mengsel?
A: De partiële druk van SO2Cl2 in een mengsel kan worden bepaald met behulp van de ideale gaswet, afhankelijk van de temperatuur, het volume en de molfractie of concentratie van SO2Cl2.
Vraag: Welk type intermoleculaire krachten worden verwacht tussen SO2Cl2-moleculen?
A: De verwachte intermoleculaire krachten tussen SO2Cl2-moleculen omvatten dipool-dipoolinteracties en London-dispersiekrachten.
Vraag: Op welk punt zal de partiële druk van SO2Cl2 afnemen tot een tiende van de oorspronkelijke waarde?
A: De tijd die nodig is om de partiële druk van SO2Cl2 te laten dalen tot een tiende van de initiële waarde hangt af van de specifieke omstandigheden van het systeem en de snelheid van de betrokken chemische reactie.
Vraag: Wat is de molaire massa van SO2Cl2?
A: De molaire massa van SO2Cl2 is ongeveer 134,97 gram per mol.
Vraag: Wat is de moleculaire geometrie van SO2Cl2?
A: De moleculaire geometrie van SO2Cl2 is gebogen of V-vormig, met een zwavelatoom in het midden gebonden aan twee zuurstofatomen en twee chlooratomen.
Vraag: Wat is de Lewis-structuur van SO2Cl2?
A: De Lewis-structuur van SO2Cl2 bestaat uit een zwavelatoom dat dubbel gebonden is aan een zuurstofatoom en een enkele binding aan een ander zuurstofatoom, waarbij twee chlooratomen gebonden zijn aan het zwavelatoom.
