Fosforpentasulfide (P2S5) is een verbinding die bestaat uit twee fosforatomen en vijf zwavelatomen. Het wordt gebruikt in verschillende toepassingen, waaronder de productie van insecticiden en smeermiddelen.
| IUPAC-naam | Fosforpentasulfide |
| Moleculaire formule | P2S5 |
| CAS-nummer | 1314-80-3 |
| Synoniemen | Fosfor (V) sulfide; Difosforpentasulfide; Fosforsulfide; Pentazwavelde fosfor |
| InChi | InChI=1S/2P.5S |
Eigenschappen van fosforpentasulfide
Fosforpentasulfide-formule
De formule voor fosforpentasulfide is P2S5. Het bestaat uit twee fosforatomen gebonden aan vijf zwavelatomen.
Fosforpentasulfide Molaire massa
De molaire massa van difosforpentasulfide kan worden berekend door de atoommassa’s van de samenstellende elementen op te tellen. De atoommassa van fosfor (P) is ongeveer 30,97 g/mol en die van zwavel (S) ongeveer 32,07 g/mol. De molaire massa van P2S5 is daarom ongeveer 222,27 g/mol.
Kookpunt van fosforpentasulfide
Difosforpentasulfide heeft een kookpunt van ongeveer 514 graden Celsius (957 graden Fahrenheit). Bij deze temperatuur ondergaat de verbinding een faseovergang van een vloeistof naar een gas.
Fosforpentasulfide Smeltpunt
Het smeltpunt van difosforpentasulfide is ongeveer 280 graden Celsius (536 graden Fahrenheit). Dit is de temperatuur waarbij de verbinding verandert van vaste naar vloeibare toestand.
Dichtheid van fosforpentasulfide g/ml
De dichtheid van difosforpentasulfide is ongeveer 2,02 g/ml. Dit geeft aan dat de verbinding relatief dicht is, met een hoge massa per volume-eenheid.
Fosforpentasulfide Molecuulgewicht
Het molecuulgewicht van difosforpentasulfide, dat de som is van de atoomgewichten van de samenstellende elementen, is ongeveer 222,27 g/mol.
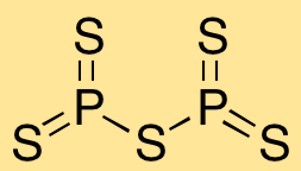
Structuur van fosforpentasulfide
Difosforpentasulfide heeft een moleculaire structuur waarin twee fosforatomen gebonden zijn aan vijf zwavelatomen. De rangschikking van de atomen vormt een trigonale bipiramidale vorm, met de fosforatomen in het midden en de zwavelatomen eromheen.
Oplosbaarheid van fosforpentasulfide
Difosforpentasulfide is slecht oplosbaar in water, waardoor het slechts in beperkte mate oplost. Het is echter beter oplosbaar in organische oplosmiddelen zoals benzeen en koolstofdisulfide.
| Verschijning | Gele vaste stof |
| Soortelijk gewicht | 2.02 |
| Kleur | GEEL |
| Geur | Scherpe geur |
| Molaire massa | 222,27 g/mol |
| Dikte | 2,02 g/ml |
| Fusie punt | 280°C (536°F) |
| Kookpunt | 514°C (957°F) |
| Flitspunt | Niet beschikbaar |
| oplosbaarheid in water | Slecht oplosbaar |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen zoals benzeen en koolstofdisulfide |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Niet beschikbaar |
Veiligheid en gevaren van fosforpentasulfide
Difosforpentasulfide brengt verschillende veiligheidsrisico’s met zich mee en voorzichtigheid is geboden bij het hanteren ervan. Het kan bij contact of inademing ernstige irritatie en brandwonden aan de huid, ogen en luchtwegen veroorzaken. Direct contact met de verbinding moet worden vermeden en beschermende handschoenen, een veiligheidsbril en ademhalingsapparatuur moeten worden gebruikt. Het is ook brandbaar en kan ontbranden bij blootstelling aan hitte of vlammen, waarbij giftige zwaveloxiden ontstaan. Een goede opslag uit de buurt van ontstekingsbronnen is noodzakelijk. Bovendien mag difosforpentasulfide niet worden gemengd met water of reactieve stoffen, omdat hierdoor brandbare of giftige gassen kunnen ontstaan. Goede ventilatie en naleving van veiligheidsprotocollen zijn cruciaal bij het werken met dit middel.
| Gevarensymbolen | Ontvlambaar, irriterend |
| Beveiligingsbeschrijving | Veroorzaakt ernstige brandwonden en oogletsel. Schadelijk bij inademing. Ontvlambare vaste stof. |
| VN-identificatienummers | VN 1340 |
| HS-code | 2812120000 |
| Gevarenklasse | 4,2 (brandbare vaste stof), 8 (corrosief) |
| Verpakkingsgroep | II |
| Toxiciteit | Giftig |
Methoden voor de synthese van fosforpentasulfide
Er kunnen verschillende methoden worden gebruikt om difosforpentasulfide te synthetiseren.
Een gebruikelijke methode voor het synthetiseren van difosforpentasulfide omvat het samen verwarmen van elementair fosfor en zwavel in een gecontroleerde omgeving, meestal in een afgesloten container. De hoge temperatuur vergemakkelijkt de reactie, wat leidt tot de vorming van difosforpentasulfide.
Een andere methode omvat het mengen van fosfortrisulfide (P4S3) met een overmaat aan zwavel en het verwarmen van het mengsel om de reactie te bevorderen. Overtollige zwavel combineert met fosfortrisulfide, wat resulteert in de productie van difosforpentasulfide.
De reactie van fosforpentachloride (PCl5) met waterstofsulfide (H2S) in aanwezigheid van een geschikt oplosmiddel, zoals koolstofdisulfide, maakt de bereiding van difosforpentasulfide mogelijk. Bij de reactie ontstaat difosforpentasulfide en komt waterstofchloride (HCl) -gas vrij als bijproduct.
Wees voorzichtig bij het gebruik van deze synthetische methoden vanwege de gevaarlijke aard van de betrokken reagentia en producten. Zorg voor passende veiligheidsmaatregelen, zoals het gebruik van geschikte beschermende uitrusting en het werken in goed geventileerde ruimtes, tijdens het syntheseproces.
Gebruik van fosforpentasulfide
Difosforpentasulfide vindt toepassingen in verschillende industrieën en processen vanwege zijn unieke eigenschappen. Hier zijn enkele toepassingen:
- Productie van insecticiden: Fabrikanten gebruiken difosforpentasulfide als een belangrijk ingrediënt bij de productie van insecticiden, vooral die bedoeld om ongedierte zoals muggen en teken te bestrijden.
- Smeermiddeladditief: Bedrijven voegen difosforpentasulfide toe aan smeermiddelen als additief om hun extreme druk- en anti-slijtage-eigenschappen te verbeteren. Dit additief verbetert de smeerprestaties en beschermt machines onder hoge belasting.
- Chemische synthese: Difosforpentasulfide fungeert als reagens bij verschillende chemische reacties, zoals de synthese van thionylchloride (SOCl2), dat veel wordt gebruikt in de organische synthese.
- Farmaceutische industrie: De farmaceutische industrie gebruikt difosforpentasulfide in onderzoeks- en ontwikkelingsprocessen om specifieke verbindingen en tussenproducten te synthetiseren.
- Metaalwinning: Metallurgische processen gebruiken difosforpentasulfide om bepaalde metalen, met name koper en zink, uit hun ertsen te extraheren. Het helpt onzuiverheden te verwijderen en vergemakkelijkt de zuivering van metalen.
- Productie van kleurstoffen en pigmenten: Difosforpentasulfide speelt een rol bij de synthese van verschillende kleurstoffen en pigmenten en dient als een belangrijke bouwsteen voor hun chemische structuur.
- Middelen voor chemische oorlogvoering: Historisch gezien is difosforpentasulfide gebruikt bij de productie van middelen voor chemische oorlogvoering. Internationale verdragen reguleren en controleren echter strikt het gebruik ervan voor deze doeleinden.
Het is belangrijk op te merken dat vanwege de gevaarlijke aard van difosforpentasulfide passende veiligheidsmaatregelen en protocollen moeten worden gevolgd bij het hanteren, opslaan en weggooien ervan.
Vragen:
Vraag: Wat is fosforpentasulfidedimeer?
A: Difosforpentasulfidedimeer verwijst naar de moleculaire structuur van twee fosforpentasulfidemoleculen die chemisch aan elkaar zijn gebonden.
Vraag: Wat is de entropie van fosforpentasulfide?
A: De entropie van difosforpentasulfide verwijst naar de meting van de moleculaire wanorde of willekeur ervan bij een gegeven temperatuur.
Vraag: Wat is de enthalpie van fosforpentasulfide?
A: De enthalpie van difosforpentasulfide verwijst naar de warmte-inhoud of energieverandering die gepaard gaat met de chemische reacties of transformaties ervan.
Vraag: Wat is P2S5?
A: P2S5 is de molecuulformule voor difosforpentasulfide, een verbinding bestaande uit twee fosforatomen gebonden aan vijf zwavelatomen.
Vraag: Hoeveel gram zwavel zit er in 45,0 g P2S5?
A: 45,0 g P2S5 bevat ongeveer 28,13 g zwavel.
Vraag: Hoeveel moleculen P2S5 heb je nodig om 222 gram te maken?
A: Er zijn ongeveer 1,54 x 10^23 moleculen P2S5 nodig om 222 gram te bereiken.
Vraag: Wat is de naam van P2S5?
A: De naam van P2S5 is fosforpentasulfide.
Vraag: Is P2S5 een zwakke elektrolyt?
A: Nee, P2S5 is geen zwakke elektrolyt; het is een niet-elektrolyt.
Vraag: Hoe weet ik of de P2S5-deeltjesgrootte onjuist is?
A: Een onjuiste deeltjesgrootte van P2S5 kan worden vastgesteld door afwijkingen van de verwachte fysische eigenschappen en het gedrag van de verbinding waar te nemen.
Vraag: Wat is P2S5 ochem2?
A: “ochem2” is geen erkende term of aanduiding voor P2S5 op het gebied van de organische chemie.
Vraag: Hoe wordt de verbinding P2S5 genoemd?
A: De verbinding P2S5 wordt difosforpentasulfide genoemd.
Vraag: Wat is P2S5 in de chemie?
A: In de chemie vertegenwoordigt P2S5 de moleculaire formule voor difosforpentasulfide, een verbinding die wordt gebruikt in verschillende toepassingen en chemische reacties.
