Fosfortrichloride is een chemische verbinding bestaande uit fosfor en drie chlooratomen. Het wordt vaak gebruikt als reagens bij chemische reacties en als voorloper van organofosforverbindingen.
| IUPAC-naam | Fosfortrichloride |
| Moleculaire formule | PCl3 |
| CAS-nummer | 7719-12-2 |
| Synoniemen | Trichloorfosfine, fosforchloride, fosfortrichloride, fosfor (III) chloride |
| InChi | InChI=1S/Cl3P/c1-4(2)3 |
Eigenschappen van fosfortrichloride
Fosfortrichloride-formule
De formule voor fosfortrichloride is PCl3. Het bestaat uit één fosforatoom gebonden aan drie chlooratomen. Deze chemische verbinding wordt veel gebruikt in verschillende industrieën en laboratoria vanwege zijn reactiviteit en veelzijdigheid.
Fosfortrichloride Molaire massa
De molaire massa van trichloorfosfine kan worden berekend door de atoommassa’s van de samenstellende elementen op te tellen. Fosfor heeft een atoommassa van ongeveer 31,0 gram per mol, terwijl chloor een atoommassa heeft van ongeveer 35,5 gram per mol. Daarom is de molaire massa van PCl3 ongeveer 137,3 gram per mol.
Kookpunt van fosfortrichloride
Trichloorfosfine heeft een kookpunt van ongeveer 76,1 graden Celsius. Dit betekent dat het bij verhitting verandert van een vloeistof in een gas. Het kookpunt is een belangrijke eigenschap waarmee rekening moet worden gehouden bij het hanteren en gebruiken van trichloorfosfine in verschillende chemische reacties en processen.
Fosfortrichloride Smeltpunt
Het smeltpunt van trichloorfosfine is ongeveer -112,7 graden Celsius. Bij deze temperatuur ondergaat het een faseovergang van vast naar vloeibaar. Het smeltpunt is een cruciaal kenmerk voor het bepalen van de fysische toestand van trichloorfosfine onder verschillende omstandigheden.
Dichtheid van fosfortrichloride g/ml
De dichtheid van trichloorfosfine is ongeveer 1,574 gram per milliliter. Dichtheid vertegenwoordigt de massa van een stof per volume-eenheid en geeft inzicht in de compactheid en zwaarte van het materiaal. De dichtheid van trichloorfosfine wordt vaak gebruikt in chemische berekeningen en formuleringen.
Fosfortrichloride Molecuulgewicht
Het molecuulgewicht van trichloorfosfine, berekend door de atoomgewichten van de bestanddelen ervan op te tellen, bedraagt ongeveer 137,3 gram per mol. Het molecuulgewicht is een waardevolle parameter voor het bepalen van de hoeveelheid stof in chemische reacties en het formuleren van nauwkeurige metingen.
Structuur van fosfortrichloride
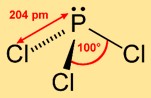
Trichloorfosfine heeft een trigonale piramidestructuur, waarbij het fosforatoom de top bezet en de drie chlooratomen een driehoekige basis vormen. Deze moleculaire rangschikking draagt bij aan de chemische reactiviteit ervan en beïnvloedt het gedrag ervan in verschillende reacties.
Oplosbaarheid van fosfortrichloride
Trichloorfosfine is slecht oplosbaar in water, maar lost gemakkelijk op in organische oplosmiddelen zoals benzeen en tetrachloorkoolstof. De oplosbaarheidseigenschappen van trichloorfosfine zijn essentiële overwegingen bij het bepalen van geschikte oplosmiddelen voor gebruik in verschillende chemische processen en toepassingen.
| Verschijning | Kleurloze of lichtgele vloeistof |
| Soortelijk gewicht | 1.574 g/ml |
| Kleur | Kleurloos |
| Geur | Akko |
| Molaire massa | 137,3 g/mol |
| Dikte | 1.574 g/ml |
| Fusie punt | -112,7°C |
| Kookpunt | 76,1°C |
| Flitspunt | Niet van toepassing (niet-ontvlambaar) |
| oplosbaarheid in water | Reageert met water |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen zoals benzeen en tetrachloorkoolstof |
| Dampdruk | 105 mmHg bij 25°C |
| Dampdichtheid | 4,83 (Lucht = 1) |
| pKa | Niet toepasbaar |
| pH | Zuur (pH < 7) |
Veiligheid en gevaren van fosfortrichloride
Trichloorfosfine brengt verschillende veiligheidsrisico’s met zich mee en moet met voorzichtigheid worden gehanteerd. Het is zeer bijtend voor de huid, ogen en luchtwegen. Direct contact kan ernstige brandwonden en oogletsel veroorzaken. Inademing van de dampen kan irritatie van de luchtwegen en longschade veroorzaken. Bovendien reageert trichloorfosfine heftig met water, waarbij giftige zoutzuurdampen vrijkomen. Het is onder bepaalde omstandigheden ontvlambaar en contact met oxidatiemiddelen kan brand of explosies veroorzaken. Bij het werken met deze chemische stof moeten adequate persoonlijke beschermingsmiddelen worden gebruikt, zoals handschoenen, een veiligheidsbril en een gasmasker. Voldoende ventilatie en opslag uit de buurt van onverenigbare stoffen zijn essentieel om de risico’s te minimaliseren.
| Gevarensymbolen | Bijtend, giftig |
| Beveiligingsbeschrijving | – Veroorzaakt ernstige brandwonden en oogletsel – Schadelijk bij inslikken, inademen of absorberen – Reageert hevig met water, waarbij giftige dampen vrijkomen – Ontvlambaar onder bepaalde omstandigheden |
| Identificatiegegevens van de Verenigde Naties | VN1809 |
| HS-code | 2812.10.00 |
| Gevarenklasse | 8 (bijtend), 6,1 (giftig) |
| Verpakkingsgroep | II |
| Toxiciteit | Zeer giftig |
Fosfortrichloridesynthesemethoden
Verschillende methoden synthetiseren trichloorfosfine. Een gebruikelijke aanpak is om de fosfor te verwarmen met een overmaat aan chloorgas, wat leidt tot de vorming van trichloorfosfine.
Een andere methode omvat het verwarmen van fosforpentachloride (PCl5) met trichloorfosfine (PCl3) om trichloorfosfine te produceren.
De reactie tussen fosforoxide (P2O5) en zoutzuur (HCl) combineert de twee stoffen, meestal met een refluxcondensor, om de synthese van trichloorfosfine te vergemakkelijken.
Bovendien resulteert het verwarmen van fosfortribromide (PBr3) met trichloorfosfine in de productie van trichloorfosfine.
Het is belangrijk op te merken dat de synthese van trichloorfosfine moet worden uitgevoerd met passende veiligheidsmaatregelen, aangezien het gaat om de omgang met reactieve en gevaarlijke stoffen. Zorg voor de veiligheid tijdens het syntheseproces door geschikte beschermende uitrusting te gebruiken en goed geventileerde laboratoriumomstandigheden te handhaven.
Over het geheel genomen bieden deze verschillende synthetische methoden verschillende benaderingen voor het verkrijgen van trichloorfosfine, waardoor flexibiliteit wordt geboden bij de productie ervan voor een breed scala aan industriële en onderzoekstoepassingen.
Gebruik van fosfortrichloride
Trichloorfosfine wordt veel gebruikt in verschillende toepassingen vanwege zijn veelzijdige aard en reactiviteit. Hier zijn enkele belangrijke toepassingen:
- Chemisch reagens: Het dient als een belangrijk reagens bij de organische synthese, vooral bij de productie van organofosforverbindingen. Het neemt deel aan reacties zoals de Vilsmeier-Haack-reactie en de Pudovik-reactie.
- Katalysator: Trichloorfosfine fungeert als katalysator bij verschillende chemische reacties, waaronder de synthese van geneesmiddelen, kleurstoffen en pesticiden.
- Fosforbron: Het dient als een bron van fosfor bij de productie van op fosfor gebaseerde chemicaliën zoals fosforzuur en fosforoxychloride.
- Vlamvertrager: Fabrikanten voegen trichloorfosfine toe als vlamvertrager aan polymeren, waardoor de ontvlambaarheid wordt verminderd en de brandveiligheid van de materialen wordt verbeterd.
- Chemisch tussenproduct: Verschillende chemicaliën, waaronder farmaceutische producten, herbiciden, insecticiden en weekmakers, worden geproduceerd met behulp van trichloorfosfine als cruciaal tussenproduct.
- Laboratoriumreagens: Laboratoria gebruiken trichloorfosfine op grote schaal als een veelzijdig reagens voor chemische reacties, waaronder de vorming van acylchloriden en de omzetting van alcoholen in alkylchloriden.
- Waterbehandeling: De sterke oxiderende en chlorerende eigenschappen van trichloorfosfine maken het tot een waardevol onderdeel in waterbehandelingsprocessen, waarbij onzuiverheden en verontreinigingen effectief worden verwijderd.
- Geneesmiddelen: Trichloorfosfine speelt een rol bij de synthese van farmaceutische verbindingen, waaronder geneesmiddelen voor de behandeling van kanker, ontstekingen en neurologische aandoeningen.
- Landbouwtoepassingen: Het vindt toepassingen in de landbouw als onderdeel van bepaalde pesticiden en herbiciden, en draagt daarmee bij aan gewasbescherming en onkruidbestrijding.
- Kunststofproductie: Fabrikanten gebruiken trichloorfosfine bij de productie van kunststoffen en polymeeradditieven om de materiaaleigenschappen te verbeteren en ze vlamvertragend te maken.
Deze verschillende toepassingen benadrukken het belang van trichloorfosfine in verschillende industrieën, onderzoek en dagelijkse toepassingen.
Vragen:
Vraag: Is fosfortrichloride een base of een zuur?
A: Trichloorfosfine is een zuur.
Vraag: Hoeveel chlooratomen zitten er in een molecuul fosfortrichloride, PCl3?
A: Er zijn drie chlooratomen in een molecuul trichloorfosfine.
Vraag: Wat is de procentuele opbrengst van een reactie waarbij 200 g fosfortrichloride reageert?
A: Het opbrengstpercentage kan niet worden bepaald zonder informatie over de verkregen hoeveelheid product.
Vraag: Hoeveel mol zit er in 15 gram fosfortrichloride?
A: Er zit ongeveer 0,116 mol trichloorfosfine in 15 gram.
Vraag: Welke formule vertegenwoordigt de binaire moleculaire verbinding fosfortrichloride?
A: De formule PCl3 staat voor trichloorfosfine.
Vraag: Wat is de formule voor fosfortrichloride?
A: De formule voor fosfortrichloride is PCl3.
Vraag: Is fosfortrichloride ionisch of covalent?
A: Trichloorfosfine is een covalente verbinding.
Vraag: Hoeveel chlooratomen zitten er in een molecuul fosfortrichloride, PCl3?
A: Er zijn drie chlooratomen in een molecuul trichloorfosfine.
Vraag: Lewis-structuur van trichloorfosfine?
A: De Lewis-structuur van trichloorfosfine heeft een centraal fosforatoom gebonden aan drie chlooratomen, met alleenstaande paren op het fosforatoom.
Vraag: Fosfor (P4) (s) + Chloor (g) → Trichloorfosfine (l)?
A: De uitgebalanceerde vergelijking vertegenwoordigt de reactie tussen vast fosfor (P4) en chloorgas (Cl2) om vloeibaar PCl3 te vormen.
Vraag: Wat is de vorm van fosfortrichloride?
A: Trichloorfosfine heeft een trigonale piramidevorm vanwege de aanwezigheid van een paar vrije elektronen op het fosforatoom.
Vraag: Is fosfortrichloride een ionische verbinding?
A: Nee, trichloorfosfine is geen ionische verbinding; het is een covalente verbinding.
Vraag: Heeft fosfortrichloride reflectievlakken?
A: Nee, trichloorfosfine heeft geen reflectievlakken.
