Natriumethoxide is een sterke base die wordt gevormd door de reactie van natrium met ethanol. Het wordt gebruikt bij de organische synthese om reacties zoals verestering en deprotonering te vergemakkelijken.
| IUPAC-naam | Natriumethoxide |
| Moleculaire formule | C2H5NaO |
| CAS-nummer | 141-52-6 |
| Synoniemen | Ethanol, natriumzout; Natriumethoxide; Ethylnatrium; Ethylaat; Natriumethylalcoholaat |
| InChi | InChI=1S/C2H5O.Na/c1-2-3;/h2-3H,1H3;/q-1;+1 |
Eigenschappen van natriumethoxide
Natriumethoxide-formule
De chemische formule voor natriumethoxide is C2H5NaO. Het bestaat uit twee koolstofatomen (C), vijf waterstofatomen (H), één natriumatoom (Na) en één zuurstofatoom (O). De formule vertegenwoordigt de verhouding van atomen die aanwezig zijn in een molecuul natriumethoxide.
Natriumethoxide molaire massa
De molaire massa van natriumethoxide wordt berekend door de atoommassa’s van alle atomen in de formule op te tellen. Natrium (Na) heeft een molaire massa van 22,99 g/mol, koolstof (C) heeft een molaire massa van 12,01 g/mol, waterstof (H) heeft een molaire massa van 1,01 g/mol mol en zuurstof (O) heeft een molaire massa. massa van 1,01 g/mol. massa van 16,00 g/mol. Hun toevoeging levert een molaire massa op van ongeveer 68,06 g/mol voor natriumethoxide.
Kookpunt van natriumethoxide
Natriumethoxide heeft een kookpunt van ongeveer 90-95°C (194-203°F). Deze temperatuur geeft het punt aan waarop natriumethoxide verandert van een vloeibare fase naar een gasfase bij verhitting onder standaard atmosferische druk.
Smeltpunt van natriumethoxide
Het smeltpunt van natriumethoxide is ongeveer 260-270°C (500-518°F). Dit betekent de temperatuur waarbij vast natriumethoxide overgaat in een vloeibare toestand.
Dichtheid van natriumethoxide g/ml
Natriumethoxide heeft een dichtheid van ongeveer 0,868 g/ml. Dichtheid verwijst naar de massa van een stof per volume-eenheid en kan worden gebruikt om de relatieve zwaarte of lichtheid ervan te bepalen in vergelijking met een gelijk volume water.
Natriumethoxide Molecuulgewicht
Het molecuulgewicht van natriumethoxide, ook wel molecuulgewicht genoemd, is ongeveer 68,06 g/mol. Het wordt berekend door de atoommassa’s van alle atomen die aanwezig zijn in een molecuul natriumethoxide op te tellen.
Structuur van natriumethoxide
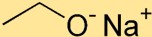
Natriumethoxide heeft een structuur waarin het natriumatoom (Na) via een ionische binding aan het zuurstofatoom (O) is gekoppeld. De ethoxidegroep, bestaande uit twee koolstofatomen (C) en vijf waterstofatomen (H), is gehecht aan het natriumatoom.
Oplosbaarheid van natriumethoxide
Natriumethoxide is zeer oplosbaar in polaire oplosmiddelen zoals ethanol (C2H5OH) en andere organische oplosmiddelen. Het lost gemakkelijk op in deze oplosmiddelen en vormt een heldere, kleurloze oplossing, waardoor het gebruik ervan als reagens in verschillende organische reacties wordt vergemakkelijkt.
| Verschijning | Kleurloze vaste stof |
| Soortelijk gewicht | 0,868 g/ml |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 68,06 g/mol |
| Dikte | 0,868 g/ml |
| Fusie punt | 260-270°C (500-518°F) |
| Kookpunt | 90-95°C (194-203°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Reageert met water |
| Oplosbaarheid | Oplosbaar in ethanol (C2H5OH) en andere organische oplosmiddelen |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Basisch (alkalisch) |
Veiligheid en gevaren van natriumethoxide
Natriumethoxide brengt verschillende veiligheidsrisico’s met zich mee en voorzichtigheid is geboden bij het hanteren ervan. Het is een bijtende stof die ernstige brandwonden aan de huid, ogen en luchtwegen kan veroorzaken. Direct contact moet worden vermeden en handschoenen, een veiligheidsbril en beschermende kleding moeten worden gedragen. Het reageert heftig met water, waarbij brandbaar waterstofgas vrijkomt, en moet uit de buurt van vocht worden bewaard. Natriumethylaat kan ook krachtig reageren met lucht, wat mogelijk kan leiden tot brand of explosies. Goede ventilatie is cruciaal om de ophoping van dampen te voorkomen. Bovendien is het belangrijk om natriumethoxide te hanteren in een goed uitgerust laboratorium met opgeleid personeel om de risico’s te minimaliseren en de veiligheid te garanderen.
| Gevarensymbolen | Bijtend |
| Beveiligingsbeschrijving | – Veroorzaakt ernstige brandwonden<br>- Reageert hevig bij contact met water<br>- Bewaar uit de buurt van vocht<br>- Ga voorzichtig te werk<br>- Gebruik beschermende uitrusting<br>- Bewaar op een droge plaats<br>- Zorg ervoor dat goede ventilatie |
| VN-identificatienummers | UN2922 |
| HS-code | 2905.19.00 |
| Gevarenklasse | 8 (Bijtende stoffen) |
| Verpakkingsgroep | II |
| Toxiciteit | Giftig bij inslikken of inademen |
Methoden voor de synthese van natriumethoxide
Er zijn verschillende methoden voor het synthetiseren van natriumethoxide.
Eén manier om natriumethoxide te synthetiseren omvat de reactie tussen metallisch natrium en ethanol . Metallisch natrium ondergaat een redoxreactie met watervrije ethanol , resulterend in de vorming van natriumethoxide. Om de reactie uit te voeren, kan men kleine stukjes natriummetaal toevoegen aan absolute ethanol en het mengsel onder gecontroleerde omstandigheden onder terugvloeikoeling koken.
Een andere methode omvat de reactie tussen natriumhydroxide (NaOH) en ethanol . Het natriumhydroxide wordt opgelost in ethanol en het mengsel wordt verwarmd, wat de reactie tot natriumethoxide bevordert. Chemici gebruiken deze methode vaak als ze niet de voorkeur geven aan de directe reactie tussen metallisch natrium en ethanol.
Als alternatief kunnen ze natriumethoxide bereiden door ethanol te laten reageren met natriumcarbonaat (Na2CO3). Los het natriumcarbonaat op in ethanol , verwarm en roer het mengsel. Dit proces leidt tot de vorming van natriumethoxide.
Opgemerkt moet worden dat deze synthesemethoden strikte naleving van veiligheidsmaatregelen vereisen vanwege de reactiviteit van de betrokken chemicaliën. Een juiste omgang met brandbare stoffen, het gebruik van beschermende uitrusting en het uitvoeren van reacties in goed geventileerde ruimtes zijn essentieel voor de persoonlijke veiligheid en de succesvolle synthese van natriumethoxide.
Gebruik van natriumethoxide
Natriumethoxide vindt verschillende toepassingen vanwege zijn reactiviteit en sterke basische aard. Hier zijn enkele veelvoorkomende toepassingen:
- Organische synthese: Natriumethoxide dient op grote schaal als een solide basis in de organische synthese. Het vergemakkelijkt reacties zoals veresterings-, condensatie- en deprotoneringsprocessen.
- Alkoxidereagens: Het dient als een alkoxidereagens, dat kan reageren met verschillende organische verbindingen om alkoxiden te vormen. Deze alkoxiden zijn cruciale tussenproducten in veel organische reacties.
- Katalysator: Natriumethoxide fungeert als katalysator bij verschillende chemische reacties. Het bevordert de omzetting van organische verbindingen, zoals alcoholen en esters, in hun overeenkomstige ethers of veresteringsproducten.
- Dehydratatiemiddel: Het dehydrateert organische verbindingen door watermoleculen te verwijderen, waardoor de synthese van watervrije producten wordt vergemakkelijkt.
- Polymerisatie: Natriumethoxide neemt deel aan polymerisatiereacties, waaronder de productie van polyethyleentereftalaat (PET) en andere polyesterpolymeren.
- Farmaceutische productie: Het vindt toepassingen in de farmaceutische industrie voor de synthese van verschillende farmaceutische verbindingen, waaronder esters, ethers en tussenproducten.
- Biodieselproductie: Bij het omesteringsproces wordt natriumethylaat gebruikt om plantaardige oliën of dierlijke vetten om te zetten in biodiesel, een hernieuwbare en milieuvriendelijke brandstof.
- Laboratoriumreagens: Onderzoekers gebruiken natriumethoxide gewoonlijk als reagens voor organische reacties en in experimentele opstellingen.
Vragen:
Vraag: Is natriumethoxide gebaseerd?
A: Ja, natriumethoxide is een base.
Vraag: Is natriumethoxide een sterke of zwakke base?
A: Natriumethoxide is een sterke base.
Vraag: Wat zou je verwachten als natriumethoxide aan water werd toegevoegd?
A: Als natriumethoxide aan water wordt toegevoegd, reageert het krachtig, waarbij waterstofgas vrijkomt en natriumhydroxide ontstaat.
Vraag: Is natriumethoxide een sterke of zwakke base?
A: Natriumethoxide is een sterke base.
Vraag: Is natriumethoxide een sterk nucleofiel?
A: Ja, natriumethoxide is een sterke nucleofiel.
Vraag: Welke van de volgende ondergaat het gemakkelijkst een E2-reactie met natriumethoxide?
A: De verbinding met een primaire of secundaire vertrekkende groep zou gemakkelijker een E2-reactie met natriumethoxide ondergaan.
Vraag: Is natriumethoxide een sterk nucleofiel?
A: Ja, natriumethoxide is een sterke nucleofiel.
Vraag: Is natriumethoxide gebaseerd?
A: Ja, natriumethoxide is een base.
Vraag: Welke van de volgende ondergaat het gemakkelijkst een E2-reactie met natriumethoxide (NaOCH2CH3)?
A: Een verbinding met een primaire of secundaire vertrekkende groep zou gemakkelijker een E2-reactie met natriumethoxide ondergaan.
Vraag: Is natriumethoxide ontvlambaar?
A: Natriumethoxide zelf is niet brandbaar, maar reageert heftig met water, waarbij brandbaar waterstofgas vrijkomt.
Vraag: Wat levert, in combinatie met ethanol, natriumethoxide en waterstof op?
A: De combinatie van natriummetaal en ethanol produceert natriumethoxide en waterstofgas.
Vraag: Wat zou je verwachten als natriumethoxide aan water werd toegevoegd?
A: Als natriumethoxide aan water zou worden toegevoegd, zou het krachtig reageren, waarbij waterstofgas vrijkomt en natriumhydroxide ontstaat.
