Lithiumhydride is een verbinding gemaakt van lithium en waterstof. Het is zeer reactief en wordt veel gebruikt in verschillende toepassingen, waaronder energieopslag en kernreacties.
| IUPAC-naam | Lithiumhydride |
| Moleculaire formule | LiH |
| CAS-nummer | 7580-67-8 |
| Synoniemen | Lithiummonohydride, lithaan, lithiumhydride, lithiumhydride |
| InChi | InChI=1S/Li.H |
Eigenschappen van lithiumhydride
Lithiumhydride-formule
De formule voor lithiummonohydride is LiH. Het bestaat uit een lithiumatoom gebonden aan een waterstofatoom. Deze eenvoudige en beknopte formule vertegenwoordigt de elementaire samenstelling van lithiummonohydride.
Molaire massa van lithiumhydride
De molaire massa van lithiummonohydride wordt berekend door de atoommassa’s van lithium (Li) en waterstof (H) op te tellen. Dit is ongeveer 7,95 gram per mol (g/mol). Molaire massa is essentieel voor verschillende berekeningen in de scheikunde, zoals het bepalen van de hoeveelheid stof in een bepaald monster.
Kookpunt van lithiumhydride
Lithiummonohydride heeft een hoog kookpunt van ongeveer 1.350 graden Celsius (2.462 graden Fahrenheit). Dit geeft aan dat er een aanzienlijke hoeveelheid energie nodig is om de vaste verbinding in de gasvormige toestand om te zetten.
Smeltpunt van lithiumhydride
Het smeltpunt van lithiummonohydride is vrij hoog, ongeveer 688 graden Celsius (1270 graden Fahrenheit). Deze temperatuur vertegenwoordigt het punt waarop de vaste verbinding bij verwarming in een vloeibare toestand verandert.
Dichtheid van lithiumhydride g/ml
De dichtheid van lithiummonohydride is ongeveer 0,82 gram per milliliter (g/ml). Deze waarde geeft aan dat lithiummonohydride een relatief dichte verbinding is, wat betekent dat het een grote massa per volume-eenheid heeft.
Molecuulgewicht van lithiumhydride
Het molecuulgewicht van lithiummonohydride wordt bepaald door de atoomgewichten van lithium en waterstof op te tellen. Dit is ongeveer 7,95 gram per mol (g/mol). Het molecuulgewicht is cruciaal bij verschillende chemische berekeningen, vooral bij het bepalen van de stoichiometrie van reacties.
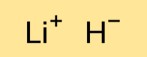
Lithiumhydridestructuur
Lithiummonohydride heeft een kristalstructuur waarin lithiumkationen (Li+) en hydride-anionen (H-) in een driedimensionaal rooster zijn gerangschikt. Lithium- en waterstofatomen worden bij elkaar gehouden door sterke ionische bindingen.
Oplosbaarheid van lithiumhydride
Lithiummonohydride is slecht oplosbaar in water. Het reageert met water en vormt lithiumhydroxide (LiOH) en waterstofgas (H2). Deze beperkte oplosbaarheid is te wijten aan de sterk ionische aard van lithiummonohydride, waardoor het minder waarschijnlijk is dat het oplost in polaire oplosmiddelen zoals water.
| Verschijning | Witte vaste stof |
| Soortelijk gewicht | 0,82 |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 7,95 g/mol |
| Dikte | 0,82 g/ml |
| Fusie punt | 688°C (1270°F) |
| Kookpunt | 1350°C (2462°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Reageert met water en vormt lithiumhydroxide (LiOH) en waterstofgas (H2). |
| Oplosbaarheid | Slecht oplosbaar |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Niet toepasbaar |
Veiligheid en gevaren van lithiumhydride
Lithiummonohydride brengt verschillende veiligheidsrisico’s met zich mee. Het reageert heftig met water, waarbij ontvlambaar waterstofgas vrijkomt en corrosief lithiumhydroxide ontstaat. Contact met vocht of lucht kan resulteren in de vorming van licht ontvlambaar waterstofgas. Er moet uiterst voorzichtig mee worden omgegaan om accidentele ontsteking of explosie te voorkomen. De verbinding is ook zeer reactief met zuren, waarbij giftig waterstofgas vrijkomt. Lithiummonohydride kan ernstige irritatie aan de huid en ogen veroorzaken, en het inademen van het stof of de dampen ervan kan ademhalingsproblemen veroorzaken. Bij het werken met lithiummonohydride moeten geschikte beschermende uitrusting, zoals handschoenen en een veiligheidsbril, worden gedragen en in een droge, goed geventileerde ruimte worden bewaard.
| Gevarensymbolen | Ontvlambaar, corrosief |
| Beveiligingsbeschrijving | Zeer reactief en brandbaar. Ga uiterst voorzichtig te werk. Vermijd contact met water, lucht en zuren. |
| VN-identificatienummers | VN 1414 |
| HS-code | 2850.00.10 |
| Gevarenklasse | 4.3 (Gevaarlijk als het nat is) |
| Verpakkingsgroep | ik (groot gevaar) |
| Toxiciteit | Giftig bij inslikken of inademen. Kan ernstige huid- en oogirritatie veroorzaken. |
Synthesemethoden voor lithiumhydride
Er kunnen verschillende methoden worden gebruikt om lithiummonohydride te synthetiseren.
Een gebruikelijke methode omvat de directe combinatie van metallisch lithium met waterstofgas. De reactie vindt plaats bij hoge temperaturen, doorgaans boven 600 graden Celsius (1112 graden Fahrenheit), in een gecontroleerde omgeving. Lithiummetaal reageert met waterstofgas om lithiummonohydride te vormen.
Een andere methode is de reductie van lithiumamide (LiNH2) met lithiummetaal. Deze reactie vindt plaats bij lagere temperaturen, ongeveer 350 tot 400 graden Celsius (662 tot 752 graden Fahrenheit). De reactie van lithiumamide met lithiummetaal produceert lithiummonohydride.
De synthese van lithiummonohydride kan ook plaatsvinden door lithiumboorhydride (LiBH4) te combineren met lithiummonohydride zelf. De reactie vindt plaats bij hoge temperaturen, meestal rond de 400 graden Celsius (752 graden Fahrenheit). Deze methode maakt de vorming van lithiummonohydride mogelijk uit gemakkelijk verkrijgbaar lithiumboorhydride.
Bovendien dient lithiumaluminiumhydride (LiAlH4) als grondstof voor de synthese van lithiummonohydride. Onder gecontroleerde omstandigheden reageert lithiumaluminiumhydride met lithiummetaal, wat resulteert in de vorming van lithiummonohydride.
Opgemerkt moet worden dat deze methoden een zorgvuldige omgang en strikte controle van de reactieomstandigheden vereisen vanwege de zeer reactieve aard van lithiummonohydride. Veiligheidsmaatregelen, zoals werken in een inerte atmosfeer en het gebruik van geschikte beschermende uitrusting, moeten tijdens het syntheseproces worden gevolgd.
Gebruik van lithiumhydride
Lithiummonohydride vindt verschillende toepassingen vanwege zijn unieke eigenschappen en reactiviteit. Hier zijn enkele toepassingen:
- Lithiummonohydride maakt de ontwikkeling mogelijk van geavanceerde waterstofopslagsystemen, waardoor efficiënte en compacte energieopslagoplossingen mogelijk worden.
- Bij kernreacties fungeert het als een bron van neutronen en vindt het toepassingen in onderzoeksfaciliteiten en kerncentrales.
- Bij de organische synthese wordt lithiummonohydride gebruikt als een krachtig reductiemiddel om verschillende functionele groepen te reduceren.
- Het genereert waterstofgas door zijn reactie met water of zuren, waardoor het waardevol is voor waterstofproductie ter plaatse.
- In combinatie met andere drijfgassen draagt lithiummonohydride bij aan de energieproductie en stuwkracht van raketmotoren.
- Lithiummonohydride speelt een rol bij de productie van deuteriumgas, dat toepassingen heeft bij de opwekking van kernenergie en bij wetenschappelijk onderzoek.
- Hydrometallurgische processen gebruiken lithiummonohydride om verschillende metalen zoals titanium en zirkonium te produceren.
- Het dient als voorloper of reagens bij de chemische synthese en draagt bij aan de vorming van organische en anorganische verbindingen.
- Sommige pyrotechnische formuleringen gebruiken lithiummonohydride om tijdens de reactie intense hitte en gassen te genereren.
- Hydrogeneringsreacties gebruiken lithiummonohydride om waterstof toe te voegen aan onverzadigde verbindingen, waardoor verzadigde verbindingen worden gevormd.
Deze uiteenlopende toepassingen benadrukken de veelzijdigheid en het belang van lithiummonohydride in meerdere industrieën en wetenschappelijke inspanningen.
Vragen:
Vraag: Wat is de formule voor het hydride gevormd door lithium?
A: De formule voor het monohydride gevormd door lithium is LiH.
Vraag: Vermindert lithiumhydride dubbele bindingen?
A: Ja, lithiummonohydride kan dubbele bindingen in organische verbindingen verminderen.
Vraag: Wat vermindert lithiumhydride?
A: LiH is een krachtig reductiemiddel dat gewoonlijk wordt gebruikt om verschillende functionele groepen in de organische synthese te verminderen.
Vraag: Is lithiumhydride ionisch of covalent?
A: Lithiummonohydride is een ionische verbinding bestaande uit Li+ kationen en H-anionen.
Vraag: Wat is het verschil tussen lithium-ionbatterijen en nikkel-metaalhydridebatterijen?
A: Li-ionbatterijen bieden een hogere energiedichtheid, een langere levensduur en een lager gewicht dan nikkel-metaalhydridebatterijen.
Vraag: Wat is het mechanisme van lithiumhydride?
A: Het mechanisme van lithiummonohydride varieert afhankelijk van de specifieke reactie en toepassing ervan. Het kan werken als reductiemiddel of reageren met water, zuren of andere verbindingen.
Vraag: Is lithiumhydride een nucleofiel?
A: Ja, lithiummonohydride kan bij bepaalde chemische reacties als nucleofiel werken.
Vraag: Welke stoffen creëert lithiumhydride?
A: Lithiummonohydride wordt voornamelijk gebruikt in industriële toepassingen, zoals energieopslagsystemen, kernreacties, waterstofproductie en chemische synthese.
Vraag: Vermindert lithiumhydride alcoholen?
A: Lithiummonohydride kan alcoholen reduceren tot de overeenkomstige alkanen of aldehyden, afhankelijk van de reactieomstandigheden en andere factoren.
