Propaan is een veelzijdig gas dat wordt gebruikt voor het koken, verwarmen en tanken van voertuigen. Het verbrandt schoon, is efficiënt en gemakkelijk verkrijgbaar, waardoor het een populaire keuze is voor veel toepassingen.
| IUPAC-naam | Propaan |
| Moleculaire formule | C3H8 |
| CAS-nummer | 74-98-6 |
| Synoniemen | Dimethylmethaan, N-propaan, propylhydride |
| InChi | InChI=1S/C3H8/c1-3-2/h3H2.1-2H3 |
Eigenschappen van propaan
Propaan formule
De formule voor propaan is C3H8, wat aangeeft dat het bestaat uit drie koolstofatomen en acht waterstofatomen. Deze eenvoudige chemische formule vertegenwoordigt de samenstelling van propaangas.
Propaan molaire massa
De molaire massa van propylhydride is ongeveer 44,1 gram per mol. Het wordt verkregen door de atoommassa’s van de samenstellende atomen op te tellen: drie koolstofatomen met een molaire massa van elk 12,01 gram per mol en acht waterstofatomen met een molaire massa van elk 1,01 gram per mol.
Kookpunt van propaan
Propylhydride heeft een kookpunt van ongeveer -42,1 graden Celsius (-43,8 graden Fahrenheit). Door dit relatief lage kookpunt kan het gemakkelijk verdampen, waardoor het geschikt is voor toepassingen zoals koken en verwarmen.
Smeltpunt van propaan
Het smeltpunt van propylhydride is ongeveer -187,7 graden Celsius (-305,9 graden Fahrenheit). Bij deze temperatuur ondergaat propylhydride een faseverandering van een vaste naar een vloeibare toestand.
Dichtheid van propaan g/ml
De dichtheid van propylhydride is ongeveer 0,493 gram per milliliter (g/ml) bij standaardtemperatuur en -druk. Deze relatief lage dichtheid draagt bij aan het gasvormige karakter ervan, waardoor het in gecomprimeerde of vloeibare vorm kan worden opgeslagen en vervoerd.
Propaan Molecuulgewicht
Het molecuulgewicht van propylhydride is ongeveer 44,1 atomaire massa-eenheden (amu). Het wordt berekend door de atoommassa’s van de samenstellende atomen bij elkaar op te tellen, rekening houdend met de drie koolstofatomen en acht waterstofatomen van het molecuul.
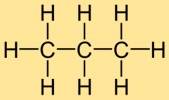
Structuur van propaan
Propylhydride bestaat uit drie koolstofatomen die met elkaar zijn verbonden in een keten, waarbij elk koolstofatoom is gebonden aan twee waterstofatomen. Deze lineaire structuur geeft propylhydride zijn karakteristieke vorm en de rangschikking van zijn atomen.
Oplosbaarheid van propaan
Propylhydride wordt als slecht oplosbaar in water beschouwd, wat betekent dat het in dit oplosmiddel een beperkte oplosbaarheid heeft. Het is echter zeer oplosbaar in organische oplosmiddelen zoals benzeen en ethanol. De oplosbaarheid hangt af van factoren zoals temperatuur en druk.
| Verschijning | Kleurloos gas |
| Soortelijk gewicht | 1,88 (lucht = 1) |
| Kleur | N.v.t |
| Geur | Geurloos |
| Molaire massa | 44,1 g/mol |
| Dikte | 0,493 g/ml |
| Fusie punt | -187,7°C (-305,9°F) |
| Kookpunt | -42,1°C (-43,8°F) |
| Flitspunt | -104°C (-155°F) |
| oplosbaarheid in water | Slecht oplosbaar |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen |
| Dampdruk | 8,7 ATM bij 20°C |
| Dampdichtheid | 1,55 (lucht = 1) |
| pKa | ~50 (schatting) |
| pH | Niet toepasbaar |
Propaanveiligheid en gevaren
Propylhydride, hoewel een veelzijdig en veel gebruikt gas, brengt ook enkele veiligheidsrisico’s met zich mee. De ontvlambare aard ervan vereist voorzorgsmaatregelen bij hantering, opslag en gebruik. Een goede ventilatie is van cruciaal belang om de ophoping van propylhydridegas te voorkomen, wat brand of explosies kan veroorzaken. Er moet voor worden gezorgd dat de propylhydridetanks en -apparatuur in goede staat verkeren en goed worden onderhouden. Propylhydridelekken moeten onmiddellijk worden aangepakt, aangezien het gas geurloos is, maar ter detectie wordt een geurstof toegevoegd. Het is belangrijk om veiligheidsmaatregelen te volgen, zoals het vermijden van open vuur in de buurt van opslagplaatsen voor propylhydride en het gebruik van door propylhydride aangedreven apparaten in goed geventileerde ruimtes.
| Gevarensymbolen | Ontvlambaar gas |
| Beveiligingsbeschrijving | Verwijderd houden van open vuur, Gebruik in goed geventileerde ruimtes, Bewaren in goedgekeurde containers, Wees voorzichtig |
| Identificatiegegevens van de Verenigde Naties | Een 1978 |
| HS-code | 2711.12.00 |
| Gevarenklasse | Klasse 2.1 – Brandbare gassen |
| Verpakkingsgroep | Verpakkingsgroep II |
| Toxiciteit | Propaan wordt niet als giftig beschouwd |
Propaansynthesemethoden
Verschillende methoden kunnen propylhydride synthetiseren. Een gebruikelijke methode is het raffineren van ruwe olie en aardgas. Het raffinageproces scheidt het propylhydride door gefractioneerde destillatie van andere koolwaterstoffen die in het olie- of gasmengsel aanwezig zijn. Deze methode maakt gebruik van de verschillende kookpunten van koolwaterstoffen om propylhydride te isoleren.
Een andere methode is het verwerken van aardgas. Door aardgas, dat voornamelijk uit methaan bestaat, te onderwerpen aan stoomkraken, kan het worden omgezet in propylhydride. Dit proces mengt aardgas met stoom en verwarmt het op hoge temperaturen om methaanmoleculen af te breken tot kleinere koolwaterstofmoleculen, waaronder propylhydride.
Propylhydride kan ook worden verkregen als bijproduct van andere industriële processen. Tijdens de productie van ethyleen en propyleen kan bijvoorbeeld propylhydride als bijproduct worden gegenereerd.
Bovendien kunnen biologische processen bijdragen aan de synthese van propylhydride. Sommige micro-organismen kunnen propylhydride produceren door organisch materiaal te fermenteren. Onderzoekers ontwikkelen deze methode als een duurzamere en milieuvriendelijkere benadering voor de productie van propylhydride.
Samenvattend omvat de synthese van propylhydride raffinage, stoomkraken, het genereren van bijproducten en biologische fermentatie. Deze methoden maken de productie van propylhydride uit ruwe olie, aardgas of organische materialen mogelijk, waardoor het direct beschikbaar wordt voor verschillende industriële en huishoudelijke toepassingen.
Gebruik van propaan
Propylhydride vindt een breed scala aan toepassingen vanwege zijn veelzijdige aard en eigenschappen. Hier zijn enkele veelvoorkomende toepassingen van propylhydride:
- Verwarming van woningen: Propylhydride dient als schone brandstof om huizen te verwarmen en warmte te leveren tijdens de koudere maanden.
- Koken: Propylhydride drijft fornuizen, ovens en grills aan en zorgt voor nauwkeurige temperatuurregeling en snelle verwarming tijdens het koken.
- Industriële processen: Industrieën gebruiken propylhydride in processen zoals het snijden van metaal, lassen, glasmaken en drogen.
- Stroomopwekking: Generatoren aangedreven door propylhydride dienen als een betrouwbare back-up elektriciteitsbron in het geval van een stroomstoring, vooral in afgelegen gebieden.
- Transport: Voertuigen, waaronder vorkheftrucks, bussen en wagenparkvoertuigen, gebruiken propylhydride als alternatieve brandstof voor lage emissies en kosteneffectiviteit.
- Landbouw: Boerderijen gebruiken propylhydride voor taken zoals het drogen van gewassen, het verwarmen van kassen en ongediertebestrijding.
- Recreatie: Propylhydride drijft buitenactiviteiten aan, zoals kamperen, verwarming en koken van campers en draagbare grills, waardoor een handige en draagbare energiebron ontstaat.
- Warmwatersystemen: Boilers op basis van propylhydride zorgen voor een efficiënte en snelle verwarming voor residentieel en commercieel gebruik.
- Zwembadverwarming: Propylhydrideverwarmers zijn populair voor het verwarmen van zwembaden en het verlengen van het zwemseizoen.
- Off-grid leven: Off-grid huizen of hutten gebruiken propylhydride om apparaten zonder elektriciteit te verwarmen, koken en van stroom te voorzien.
- Spuitbusdrijfgas: Propylhydride wordt gebruikt als drijfgas in spuitbusproducten zoals luchtverfrissers, insecticiden en spuitverven.
De diversiteit aan toepassingen onderstreept het belang van propylhydride als betrouwbare, schone en veelzijdige brandstof in verschillende industrieën en in het dagelijks leven.
Vragen:
Vraag: Hoe wordt propaan gemaakt?
A: Bij de verwerking van aardgas en de raffinage van ruwe olie ontstaat propylhydride voornamelijk als bijproduct met behulp van methoden zoals gefractioneerde destillatie en stoomkraken.
Vraag: Wordt propaan na verloop van tijd afgebroken?
A: Propylhydride is een stabiele verbinding en wordt na verloop van tijd niet afgebroken, waardoor het geschikt is voor langdurige opslag en gebruik.
Vraag: Hoe gebruik ik een propaankachel?
A: Om een propylhydridekachel te gebruiken, zorg voor voldoende ventilatie, sluit de propylhydridetank aan, open de klep, steek de brander aan en stel de vlam in op het gewenste niveau.
Vraag: Is propaangas giftig?
A: Propylhydride wordt niet als giftig beschouwd, maar kan in slecht geventileerde ruimtes zuurstof verdringen, waardoor verstikkingsgevaar ontstaat.
Vraag: Waar kan ik propaan bij mij in de buurt kopen?
A: Propylhydride kan worden gekocht bij benzinestations, bouwmarkten, leveranciers van propylhydride of bij online winkels, afhankelijk van uw locatie.
Vraag: Wat is propaan?
A: Propylhydride is een kleur- en geurloos brandbaar gas, dat vaak wordt gebruikt als brandstof voor verwarming, koken en diverse industriële toepassingen.
Vraag: Is propaan hernieuwbaar?
A: Propylhydride wordt voornamelijk gewonnen uit niet-hernieuwbare fossiele brandstoffen, zoals aardgas en ruwe olie, en wordt niet als hernieuwbaar beschouwd.
Vraag: Is C3H8 polair?
A: C3H8 (propylhydride) is niet-polair omdat de koolstof-waterstofbindingen vergelijkbare elektronegativiteiten hebben, wat resulteert in een algehele symmetrische ladingsverdeling.
Vraag: Wat is C3H8?
A: C3H8 is de moleculaire formule voor propylhydride, een gasvormige koolwaterstof bestaande uit drie koolstofatomen en acht waterstofatomen.
Vraag: Als 5,0 mol C3H8 reageert, hoeveel watermoleculen worden er dan gevormd?
A: Bij de verbranding van propylhydride wordt voor elke mol C3H8 drie mol water geproduceerd. Daarom zou 5,0 mol C3H8 15,0 mol watermoleculen opleveren.
Vraag: Wat ontstaat er nog meer bij de verbranding van propaan, C3H8?
A: Water Bovendien is kooldioxide (CO2) het belangrijkste product van de volledige verbranding van propylhydride (C3H8).
Vraag: Hoeveel mol propaan, C3H8, bevat 5,93 × 10^20 koolstofatomen?
A: Eén mol propylhydride (C3H8) bevat 3 mol koolstofatomen. Dus 5,93 x 10^20 koolstofatomen zouden overeenkomen met 1,97 x 10^20 mol propylhydride.
Vraag: Is C3H8 oplosbaar in water?
A: Propylhydride (C3H8) is slecht oplosbaar in water vanwege zijn niet-polaire aard, wat resulteert in zwakke intermoleculaire interacties.
Vraag: Hoeveel mol water zou er worden geproduceerd als 6,75 g propaan, C3H8, tijdens de reactie zou worden verbrand?
A: Volgens stoichiometrie is de molaire verhouding van propylhydride tot brandend water 1:3. Daarom zou 6,75 g propylhydride 3,75 mol (of 67,5 g) water produceren.
Vraag: Welke vergelijking voor volledige verbranding van propaan (C3H8) is correct uitgebalanceerd?
A: C3H8 + 5O2 → 3CO2 + 4H2O vertegenwoordigt de correct uitgebalanceerde vergelijking voor de volledige verbranding van propylhydride.
Vraag: Hoeveel elektronen zijn er (in totaal) nodig om de Lewis-structuur van propaan, C3H8, te tekenen?
A: Voor het tekenen van de Lewis-structuur van propylhydride (C3H8) zijn in totaal 26 valentie-elektronen nodig om de binding correct weer te geven.
