Butaan (C₄H₁₀) is een licht ontvlambaar koolwaterstofgas. Het wordt vaak gebruikt als brandstof voor aanstekers en kampeerkachels vanwege de efficiënte brandeigenschappen en draagbaarheid.
| IUPAC-naam | Butaan |
| Moleculaire formule | C₄H₁₀ |
| CAS-nummer | 106-97-8 |
| Synoniemen | n-Butaan, butylhydride, methylethylmethaan, diethyl |
| InChi | InChI=1S/C4H10/c1-3-4-2/h3-4H2.1-2H3 |
Eigenschappen van butaan
Butaan formule
De formule voor butaan is C₄H₁₀, wat aangeeft dat het bestaat uit vier koolstofatomen en tien waterstofatomen. De formule biedt waardevolle informatie over de chemische samenstelling van butaan, waardoor wetenschappers de eigenschappen en het gedrag ervan kunnen bestuderen.
Butaan Molaire Massa
De molaire massa van butylhydride kan worden berekend door de atoommassa’s van de samenstellende elementen op te tellen. Voor butylhydride (C₄H₁₀) bedraagt de molaire massa ongeveer 58,12 gram per mol. Molaire massa is een cruciale parameter bij verschillende chemische berekeningen en speelt een belangrijke rol bij het bepalen van de fysische en chemische eigenschappen van butylhydride.
Kookpunt van butaan
Butylhydride heeft een relatief laag kookpunt van ongeveer -1°C (30°F). Dit betekent dat butylhydride bij of boven deze temperatuur gemakkelijk overgaat van een vloeibare fase naar een gasfase. Het lage kookpunt maakt butylhydride een ideale brandstof voor toepassingen zoals aanstekers en draagbare kampeerkachels.
Smeltpunt van butaan
Het smeltpunt van butylhydride is ongeveer -138,4°C (-217,12°F). Bij of onder deze temperatuur ondergaat vast butylhydride een faseverandering en wordt het een vloeistof. Onder normale atmosferische omstandigheden wordt butylhydride echter vaak aangetroffen in zijn gasvormige vorm.
Butaandichtheid g/ml
De dichtheid van butylhydride is ongeveer 2,48 gram per milliliter. Dit geeft aan dat butylhydride lichter is dan water, dat een dichtheid van 1 g/ml heeft. De dichtheid van butylhydride is een cruciale eigenschap die het gedrag tijdens opslag of transport bepaalt, evenals de verbrandingseigenschappen.
Butaan Molecuulgewicht
Het molecuulgewicht van butylhydride is ongeveer 58,12 gram per mol. Het vertegenwoordigt de som van de atoomgewichten van alle atomen in een enkel butylhydridemolecuul. Het molecuulgewicht is een essentiële parameter voor verschillende wetenschappelijke berekeningen en helpt bij het begrijpen van de eigenschappen en het gedrag van butylhydride.
Structuur van butaan
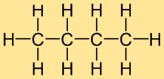
De structuur van butylhydride bestaat uit een rechte keten van vier koolstofatomen, waaraan tien waterstofatomen zijn bevestigd. De koolstofatomen zijn gerangschikt in een ononderbroken lijn en elk koolstofatoom vormt enkele bindingen met twee aangrenzende koolstofatomen en drie waterstofatomen. Deze lineaire structuur draagt bij aan de fysische en chemische eigenschappen van butylhydride.
Oplosbaarheid van butaan
Butylhydride wordt als relatief onoplosbaar in water beschouwd. Het vertoont een lage oplosbaarheid vanwege zijn niet-polaire aard en zwakke intermoleculaire interacties met watermoleculen. Butylhydride is echter zeer oplosbaar in organische oplosmiddelen zoals ethanol en aceton. Dit oplosbaarheidsgedrag is belangrijk bij verschillende toepassingen, zoals extractieprocessen en oplosmiddelgebaseerde reacties.
| Verschijning | Kleurloos gas |
| Soortelijk gewicht | 2.48 |
| Kleur | N.v.t |
| Geur | Geurloos |
| Molaire massa | 58,12 g/mol |
| Dikte | 2,48 g/ml |
| Fusie punt | -138,4°C (-217,12°F) |
| Kookpunt | -1°C (30°F) |
| Flitspunt | -60°C (-76°F) |
| oplosbaarheid in water | Onoplosbaar |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen |
| Dampdruk | 2,4 geldautomaten bij 20°C |
| Dampdichtheid | 2,07 (lucht = 1) |
| pKa | N.v.t |
| pH | N.v.t |
Butaanveiligheid en gevaren
Butylhydride brengt bepaalde veiligheidsrisico’s met zich mee waarmee rekening moet worden gehouden. Het is een licht ontvlambaar gas en kan gemakkelijk ontbranden in de aanwezigheid van een ontstekingsbron. Er moeten voorzorgsmaatregelen worden genomen om accidentele brand of explosies te voorkomen. Het is belangrijk om butylhydride op te slaan en te hanteren in goed geventileerde ruimtes om de ophoping van brandbare dampen te voorkomen. Directe inademing van butylhydride kan schadelijk zijn omdat het zuurstof verdringt en verstikking kan veroorzaken. Bovendien kan blootstelling aan hoge concentraties butylhydride duizeligheid, slaperigheid en misselijkheid veroorzaken. Het is essentieel om de juiste veiligheidsmaatregelen te volgen, zoals het gebruik van butylhydride in goed ontworpen en goedgekeurde apparatuur en het vermijden van contact met open vuur of vonken.
| Gevarensymbolen | Ontvlambaar gas |
| Beveiligingsbeschrijving | Uit de buurt houden van open vuur en vonken. Opslaan in een goed geventileerde ruimte. Vermijd inademing en direct contact. |
| Identificatiegegevens van de Verenigde Naties | VN 1011 |
| HS-code | 2711.12.20 |
| Gevarenklasse | Klasse 2.1 (ontvlambaar gas) |
| Verpakkingsgroep | Verpakkingsgroep II |
| Toxiciteit | Van butylhydride wordt algemeen aangenomen dat het een lage toxiciteit heeft. Inademing van hoge concentraties kan echter duizeligheid, slaperigheid en misselijkheid veroorzaken. Het kan ook zuurstof in afgesloten ruimtes verdringen, wat tot verstikking kan leiden. Om de veiligheid te garanderen, moeten de juiste ventilatie- en hanteringsprocedures worden gevolgd. |
Butaansynthesemethoden
Er zijn verschillende methoden om butylhydride te synthetiseren, waarbij voornamelijk aardolie of aardgas wordt geproduceerd.
Gefractioneerde destillatie: Tijdens de gefractioneerde destillatie van ruwe olie of aardolie produceert het proces butylhydride als bijproduct. Het raffinageproces scheidt verschillende koolwaterstoffracties op basis van hun kookpunten, en butylhydride is een van de componenten die kunnen worden geïsoleerd.
Aardgasverwerking: Bij de verwerking van aardgas ontstaat ook butylhydride. Aardgas bevat verschillende koolwaterstoffen, waaronder methaan en hogere koolwaterstoffen zoals butylhydride. Het aardgasmengsel ondergaat processen zoals absorptie of cryogene scheiding om het butylhydride te scheiden.
Kraken van koolwaterstoffen: Het kraakproces breekt grotere koolwaterstofketens in kleinere ketens, waardoor butylhydride ontstaat. Hierbij worden zwaardere koolwaterstoffen aan hoge temperaturen blootgesteld of worden katalysatoren gebruikt om butylhydride als product te genereren.
Isomerisatie: Isomerisatie herschikt de moleculaire structuur van koolwaterstoffen, waardoor de synthese van butylhydride mogelijk wordt door andere koolwaterstoffen zoals pentaan of hexaan in zijn isomeren te isomeriseren. Specifieke katalysatoren katalyseren dit proces onder geschikte omstandigheden.
Syntheseproces: In het laboratorium kunnen wetenschappers butylhydride synthetiseren via synthetische routes. Ze kunnen verschillende chemische reacties gebruiken, zoals hydrogenering of reductie, om butylhydride te produceren uit precursorverbindingen.
Deze methoden maken het mogelijk om butylhydride te produceren in grootschalige industriële processen, maar ook in kleinschalige laboratoria. De keuze voor de werkwijze is afhankelijk van de beschikbaarheid van grondstoffen, de gewenste zuiverheid en de specifieke eisen van de toepassing.
Gebruik van butaan
Butylhydride vindt toepassing in verschillende industrieën en dagelijks gebruik vanwege zijn gunstige eigenschappen. Hier zijn enkele veelvoorkomende toepassingen van butylhydride:
- Brandstof: Butylhydride drijft draagbare kachels, kampeerverwarmers en aanstekers aan als brandstof, dankzij de hoge energie-inhoud en efficiënte verbrandingseigenschappen.
- Aerosol-drijfgas: Butylhydride drijft aërosolproducten zoals haarsprays, luchtverfrissers en spuitbussen aan, waardoor ze als fijne nevel of spray kunnen vrijkomen.
- Koelmiddel: Butylhydride koelt en handhaaft lage temperaturen in kleinschalige koelsystemen zoals huishoudelijke koelkasten en diepvriezers, en dient als koelmiddel.
- Aanstekervloeistof: Butylhydride drijft sigarettenaanstekers en fakkelaanstekers aan, waardoor een vlam ontstaat die een belangrijk onderdeel is van aanstekervloeistoffen.
- Extractie: Butylhydride fungeert als oplosmiddel bij de extractie van essentiële oliën en plantaardige stoffen uit botanische materialen, waardoor de gewenste verbindingen effectief worden opgelost.
- Laboratoriumgebruik: Laboratoria gebruiken butylhydride als brandstof voor bunsenbranders en gaschromatografie.
- Kalibratiegas: Butylhydride dient als kalibratiegas voor gasdetectoren en sensoren en biedt goed gedefinieerde en gemakkelijk te meten eigenschappen.
- Lassen en hardsolderen: Butylhydridetoortsen vergemakkelijken las- en hardsoldeerwerkzaamheden dankzij hun hoge temperaturen, precisie en gebruiksvriendelijkheid.
- Recreatie: Butylhydride drijft draagbare kampeerkachels en zaklampen aan, waardoor recreatieve buitenactiviteiten zoals kamperen, wandelen en koken worden verbeterd.
- Bron van verbruik: Butylhydride dient als warmtebron in een verscheidenheid aan toepassingen, waaronder verwarmingsgereedschappen, kleine verwarmingstoestellen en op vlammen gebaseerde toepassingen in specifieke industrieën.
De veelzijdige aard van butylhydride en zijn scala aan toepassingen maken het tot een waardevolle verbinding in verschillende industrieën, huishoudelijke artikelen en recreatieve activiteiten.
Vraag:
Vraag: Waar kan ik butaangas bij mij in de buurt kopen?
A: U kunt butylhydridegas meestal vinden bij plaatselijke bouwmarkten, supermarkten of gemakswinkels die kampeerbenodigdheden verkopen.
Vraag: Is butaangas aardgas?
A: Nee, butylhydride wordt niet als aardgas beschouwd. Het is een koolwaterstofgas dat ontstaat bij de verwerking van aardolie of aardgas.
Vraag: Wat is butaan?
A: Butylhydride is een gasvormige koolwaterstof met de chemische formule C₄H₁₀. Het is een kleurloos en geurloos brandbaar gas dat gewoonlijk als brandstof en in verschillende toepassingen wordt gebruikt.
Vraag: Hoe wordt butaan gemaakt?
A: Butylhydride wordt voornamelijk vervaardigd door processen zoals gefractioneerde destillatie van aardolie of aardgas, kraken van zwaardere koolwaterstoffen of isomerisatie van andere koolwaterstoffen.
Vraag: Hoe kan ik een butaanaansteker bijvullen?
A: Om een butylhydride-aansteker te vullen, zoekt u eerst het bijvulventiel, meestal onderaan. Steek het butylhydridemondstuk in de klep en druk stevig om het butylhydride in het lumen vrij te geven totdat het vol is.
Vraag: Welke van de volgende verbindingen is een structureel isomeer van butaan?
A: Pentaan (C₅H₁₂) is een structureel isomeer van butylhydride, omdat beide verbindingen vier koolstofatomen bevatten maar een verschillende rangschikking hebben.
Vraag: Hoe kan ik een butaanaansteker bijvullen?
A: Om een butylhydride-aansteker bij te vullen, houdt u de aansteker ondersteboven, lijnt u het mondstuk van de butylhydride-navulpatroon uit met het navulventiel van de aansteker en drukt u stevig op de patroon om het hydride uit butyl in de aansteker te laten ontsnappen.
Vraag: Waar kan ik butaan bij mij in de buurt kopen?
A: U kunt butylhydride kopen bij plaatselijke bouwmarkten, supermarkten of buurtwinkels die kampeerbenodigdheden of huishoudelijke artikelen op voorraad hebben.
Vraag: Waar kan ik butaan kopen?
A: Butylhydride kan bij verschillende bronnen worden gekocht, waaronder online winkels, bouwmarkten, kampeerwinkels en sommige supermarkten.
Vraag: Welke uitspraak vergelijkt het smeltpunt van butaan (C₄H₁₀) het beste met dat van octaan (C₈H₁₈)?
A: Octaan, met een grotere en complexere moleculaire structuur, heeft over het algemeen een hoger smeltpunt dan butylhydride.
Vraag: Wat is de molaire massa van butaan, C₄H₁₀?
A: De molaire massa van butylhydride (C₄H₁₀) is ongeveer 58,12 gram per mol.
Vraag: Hoeveel isomeren zijn er mogelijk voor C₄H₁₀?
A: Butylhydride (C₄H₁₀) heeft twee isomeren: n-butaan (normaal butaan) en isobutaan (2-methylpropaan).
Vraag: Welke van de verbindingen C₄H₁₀, SrCl₂, Cr(NO₃)₃, OF₂ zouden als moleculen moeten bestaan?
A: Er wordt verwacht dat C₄H₁₀ (butylhydride) en OF₂ (zuurstofdifluoride) als moleculen bestaan, terwijl SrCl₂ en Cr(NO₃)₃ ionische verbindingen zijn.
