EDTA is een polycarbonzuuraminozuur dat metaalionen kan cheleren. Het heeft de formule [CH2N(CH2CO2H)2]2. Het helpt zware metalen uit het lichaam te verwijderen. EDTA bewaart ook bloedmonsters en voedselproducten.
| Naam Iupac | 2,2′,2″,2″‘-(ethaan-1,2-diyldiammonia)dinatriumtetraacetaat |
| Moleculaire formule | C10H14N2Na2O8 |
| CAS-nummer | 139-33-3 |
| Synoniemen | Dinatriumzout van (ethyleendinitrilo)tetra-azijnzuur, dinatriumedetaat, dinatrium-EDTA, dinatriumedetaat, dinatrium-EDTA, dinatriumzout van EDTA, disoïdezout van ethyleenbis (iminodiazijnzuur), N,N’-1,2-ethaandiylbis [N-(carboxymethyl )glycine], dinatriumzout, Na2-EDTA, Na2H2EDTA |
| Inchi | InChI=1S/C10H16N2O8.2Na/c13-7(14)3-11(4-8(15)16)1-2-12(5-9(17)18)6-10(19)20;;/ h1-6H2,(H,13,14)(H,15,16)(H,17,18)(H,19,20);;/q;2*+1/p-2 |
Eigenschappen van EDTA
EDTA-formule
EDTA staat voor ethyleendiaminetetra-azijnzuur, een synthetische organische verbinding die metaalionen kan cheleren. De formule van EDTA is C10H16N2O8, wat betekent dat het 10 koolstofatomen, 16 waterstofatomen, 2 stikstofatomen en 8 zuurstofatomen in zijn molecuul bevat.
EDTA molaire massa
De molaire massa van dinatriumedetaat is de som van de atoommassa’s van alle atomen in de formule. De atoommassa’s van koolstof, waterstof, stikstof en zuurstof zijn respectievelijk 12,01 g/mol, 1,01 g/mol, 14,01 g/mol en 16,00 g/mol. . Daarom is de molaire massa van dinatriumedetaat (10 x 12,01) + (16 x 1,01) + (2 x 14,01) + (8 x 16,00) = 292,24 g/mol.
Kookpunt van EDTA
Het kookpunt van een stof is de temperatuur waarbij deze overgaat van een vloeistof naar een gas. Het kookpunt van dinatriumedetaat is niet eenvoudig te meten, omdat het ontleedt voordat het zijn kookpunt bereikt. Sommige bronnen schatten echter dat het kookpunt van dinatriumedetaat ongeveer 614,2 ° C bedraagt bij een druk van 760 mmHg.
EDTA Smeltpunt
Het smeltpunt van een stof is de temperatuur waarbij deze overgaat van vast naar vloeibaar. Het smeltpunt van dinatriumedetaat hangt af van de mate van hydratatie en kristallisatie. De watervrije vorm van dinatriumedetaat heeft een smeltpunt van ongeveer 240°C, terwijl de dihydraatvorm een smeltpunt heeft van ongeveer 248°C.
EDTA-dichtheid g/ml
De dichtheid van een stof is de massa per volume-eenheid. De dichtheid van dinatriumedetaat varieert ook afhankelijk van de mate van hydratatie en kristallisatie. De watervrije vorm van dinatriumedetaat heeft een dichtheid van ongeveer 0,86 g/ml, terwijl de dihydraatvorm een dichtheid heeft van ongeveer 1,6 g/ml.
EDTA-molecuulgewicht
Het molecuulgewicht van een stof is een andere term voor de molmassa ervan, namelijk de massa van één mol van de stof. Zoals hierboven vermeld, is de molaire massa van dinatriumedetaat 292,24 g/mol, dus het molecuulgewicht is ook 292,24 g/mol.
Structuur van EDTA
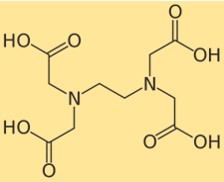
De structuur van dinatriumedetaat laat zien hoe de atomen in het molecuul zijn gerangschikt en gebonden. Dinatriumedetaat heeft een centrale ethyleendiaminegroep waaraan vier carbonzuurgroepen zijn bevestigd. Elke carbonzuurgroep kan een proton verliezen en een negatieve lading vormen, die zich aan een metaalion kan binden. De structuur van dinatriumedetaat kan worden weergegeven door het volgende diagram:
Oplosbaarheid van EDTA
De oplosbaarheid van een stof is de hoeveelheid die bij een bepaalde temperatuur en druk in een bepaald oplosmiddel kan oplossen. De oplosbaarheid van dinatriumedetaat hangt af van de pH en de aanwezigheid van metaalionen in de oplossing. Dinatriumedetaat is beter oplosbaar in alkalische oplossingen dan in zure oplossingen, omdat het meer negatieve ladingen vormt die kunnen interageren met watermoleculen. Dinatriumedetaat kan ook complexen vormen met metaalionen, waardoor de oplosbaarheid ervan kan toenemen of afnemen, afhankelijk van de stabiliteit en lading van het complex. Bij pH 7 en 25 °C is de oplosbaarheid van dinatriumedetaat in water bijvoorbeeld ongeveer 0,5 M (186 mg/ml), terwijl de oplosbaarheid van het calciumcomplex ervan ongeveer 0,02 M (7 mg/ml) is.
| Verschijning | Witte kristallijne vaste stof |
| Specifieke dichtheid | Niet beschikbaar |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 292,24 g/mol |
| Dikte | 1,6 g/ml (dihydraat), 0,86 g/ml (watervrij) |
| Fusie punt | 248°C (dihydraat), 240°C (watervrij) |
| Kookpunt | 614,2°C (ontleedt) |
| Flitspunt | 325,2°C |
| oplosbaarheid in water | 0,5 M (186 mg/ml) bij pH 7 en 25 °C |
| Oplosbaarheid | Oplosbaar in alkalische oplossingen, onoplosbaar in organische oplosmiddelen |
| Dampdruk | 3,77 x 10^-12 mmHg bij 25°C |
| Dampdichtheid | Niet beschikbaar |
| pKa | 2,0, 2,7, 6,2, 10,3 |
| pH | 4 tot 6 (0,26 M oplossing) |
Veiligheidsrisico’s van EDTA
Dinatriumedetaat is een synthetische organische verbinding die metaalionen kan cheleren. De toepassingen zijn divers op het gebied van geneeskunde, industrie, landbouw en onderzoek. Als er niet op de juiste manier mee wordt omgegaan, brengt het echter ook bepaalde risico’s met zich mee voor de menselijke gezondheid en het milieu.
Dinatriumedetaat kan de huid en ogen irriteren als het ermee in contact komt. Het kan bij inslikken ook misselijkheid, braken, diarree en buikpijn veroorzaken. Bij inademing kan het de luchtwegen beschadigen. Het kan de bloedcellen en de nieren aantasten als het in het lichaam wordt opgenomen. Het kan in grote doses dodelijk zijn.
Dinatriumedetaat kan ook de bodem en het water verontreinigen als het in het milieu terechtkomt. Het kan zich binden aan essentiële metalen en de beschikbaarheid ervan voor planten en dieren beïnvloeden. Het kan biologische processen verstoren die afhankelijk zijn van metaalionen.
Gebruik dinatriumedetaat met voorzichtigheid en met de juiste beschermende uitrusting. Bewaar het op een koele, droge, goed geventileerde plaats. Voer het af volgens de plaatselijke regelgeving.
| Gevarensymbolen | |
| Beveiligingsbeschrijving | S24/25: Vermijd contact met huid en ogen |
| VN-identificatienummers | UN3077 (vast), UN3082 (vloeistof) |
| HS-code | 29224985 |
| Gevarenklasse | 9 (diverse gevaarlijke materialen) |
| Verpakkingsgroep | III (laag gevaar) |
| Toxiciteit | Orale LD50 rat: 2000 mg/kg |
EDTA-synthesemethoden
Er zijn verschillende methoden om dinatriumedetaat te synthetiseren, maar de meest voorkomende is de condensatie van ethyleendiamine met chloorazijnzuur of het natriumzout ervan.
De reactie omvat twee stappen: ten eerste vormt de nucleofiele aanval van ethyleendiamine op chloorazijnzuur of het natriumzout ervan een monoamide-tussenproduct. Ten tweede vormt de verwijdering van zoutzuur of natriumchloride een carbonzuurgroep. Om dinatriumedetaat te vormen, kan het worden omgezet met een ander equivalent chloorazijnzuur of het natriumzout ervan.
Een andere methode om dinatriumedetaat te synthetiseren is de oxidatie van ethyleendiamine met natriumhypochloriet in een alkalische oplossing. Deze methode produceert dinatriumedetaat als natriumzout en ammoniak als bijproduct.
Andere methoden voor het synthetiseren van dinatriumedetaat zijn onder meer het laten reageren van ethyleendiamine met formaldehyde en natriumcyanide of het laten reageren van ethyleendiamine met glyoxylzuur of de esters ervan.
Gebruik van EDTA
Dinatriumedetaat is een synthetische organische verbinding die metaalionen kan cheleren. Het heeft verschillende toepassingen in verschillende velden en industrieën. Enkele toepassingen van Edetate Disodium zijn:
- In de geneeskunde kan dinatriumedetaat vergiftiging door zware metalen behandelen door zich aan giftige metalen te binden en deze uit het lichaam te verwijderen. Het kan ook bloedstolsels en verkalking van de slagaders voorkomen door calciumionen te cheleren.
- In voedingsmiddelen en dranken kan dinatriumedetaat de kleur, smaak en textuur van producten behouden door oxidatie en ranzigheid te voorkomen. Het kan ook verkleuring en bederf veroorzaakt door metaalionen voorkomen.
- In cosmetica en persoonlijke verzorging kan dinatriumedetaat de stabiliteit en effectiviteit van producten verbeteren door microbiële groei en door metaal gekatalyseerde reacties te voorkomen. Het kan ook het uiterlijk en het gevoel van producten verbeteren door mineralen te cheleren die verantwoordelijk zijn voor de waterhardheid.
- In de industrie en het onderzoek kan dinatriumedetaat de prestaties en kwaliteit van producten en processen verbeteren door storende metaalionen te cheleren. Het kan bijvoorbeeld kalkvorming in ketels en leidingen voorkomen, het verven en bedrukken van textiel verbeteren, roest en vlekken van metalen verwijderen en de pH en metaalconcentratie controleren bij analytische methoden.
Vragen:
Vraag: Wat is EDTA?
A: Dinatriumedetaat is een synthetische organische verbinding die metaalionen kan cheleren. Het staat voor ethyleendiaminetetra-azijnzuur.
Vraag: Hoe bereid ik een EDTA-oplossing voor?
A: Om een dinatriumedetaatoplossing te bereiden, weegt u de gewenste hoeveelheid dinatriumedetaat af en lost u deze op in gedestilleerd water. Pas de pH aan tot 8,0 met natriumhydroxide.
Vraag: Hoe EDTA in water oplossen?
A: Dinatriumedetaat is oplosbaar in water, maar lost langzaam op. Om dinatriumedetaat in water op te lossen, verwarmt u het water tot ongeveer 80°C en roert u het mengsel totdat het dinatriumedetaat volledig oplost.
Vraag: Hoe bereid ik 0,5M EDTA voor?
A: Om 0,5M dinatriumedetaat te bereiden, weegt u 73,06 g dinatriumedetaat af en lost u dit op in 800 ml gedestilleerd water. Pas de pH aan op 8,0 met natriumhydroxide en verdun de oplossing tot 1 liter met gedestilleerd water.
Vraag: Wat doet EDTA?
A: Dinatriumedetaat bindt zich aan metaalionen en vormt daarmee stabiele complexen. Dit voorkomt dat metaalionen reageren met andere stoffen of de analysemethoden verstoren.
Vraag: Wat betekent EDTA?
A: Dinatriumedetaat betekent ethyleendiaminetetra-azijnzuur, wat de naam is van de verbinding met de formule [CH2N(CH2CO2H)2]2.
Vraag: Hoe bereken ik de waterhardheid door middel van EDTA-titratie?
A: Om de waterhardheid te berekenen door middel van titratie van dinatriumedetaat, titreert u een bekend volume watermonster met een standaardoplossing van dinatriumedetaat met behulp van een geschikte indicator. Noteer het gebruikte volume dinatriumedetaat en gebruik de volgende formule: Hardheid (mg/l als CaCO3) = (volume EDTA x molariteit EDTA x 1000) / volume watermonster
