Bariumnitraat (Ba(NO3)2) is een witte vaste stof. Het lost op in water en vormt barium- en nitraationen. Het kan ontploffen bij verhitting of vermenging met brandstoffen.
| Naam van IUPAC | Bariumdinitraat |
| Moleculaire formule | Ba(NO3)2 |
| CAS-nummer | 10022-31-8 |
| Synoniemen | Bariumnitraat, Bariumdinitraat, Bariumdinitraat, CQ9625000, (nitrooxy)barionitraat |
| InChi | InChI=1S/Ba.2NO3/c;2 2-1(3)4/q+2;2 -1 |
Eigenschappen van bariumnitraat
Bariumnitraatformule
De molecuulformule voor bariumnitraat is Ba(NO3)2. Het laat zien dat een bariumnitraatmolecuul bestaat uit één bariumatoom en twee nitraatmoleculen. Het nitraation heeft een lading van -1 en het bariumion heeft een lading van +2, dus combineren ze in een verhouding van 1:2 om een neutrale verbinding te vormen.
Bariumnitraat Molaire massa
De molmassa van Ba(NO3)2 bedraagt 261,337 g/mol. Het is de massa van één mol Ba(NO3)2-moleculen. Om het te berekenen, moet je de atoommassa’s van alle atomen in de formule optellen:
Molaire massa van Ba(NO3)2 = (1 x 137,327) + (2 x 14,007) + (6 x 15,999) = 261,337 g/mol
Kookpunt van bariumnitraat
Het kookpunt van Ba(NO3)2 bedraagt 83°C. Dit is de temperatuur waarbij Ba(NO3)2 overgaat van de vloeibare toestand naar de gasvormige toestand. Ba(NO3)2 ontleedt echter voordat het zijn kookpunt bereikt, dus het is niet mogelijk om het te koken zonder het in andere stoffen op te splitsen.
Bariumnitraat Smeltpunt
Het smeltpunt van Ba(NO3)2 bedraagt 592°C. Dit is de temperatuur waarbij Ba(NO3)2 overgaat van vast naar vloeibaar. Ba(NO3)2 is bij kamertemperatuur en druk een witte kristallijne vaste stof, maar smelt bij verhitting boven het smeltpunt.
Dichtheid van bariumnitraat g/ml
De dichtheid van Ba(NO3)2 bedraagt 3,23 g/ml. Dit is de massa per volume-eenheid van Ba(NO3)2. Om dit te berekenen, moet je de massa van een Ba(NO3)2-monster delen door het volume:
Dichtheid van Ba(NO3)2 = Massa / Volume
Als we bijvoorbeeld een monster Ba(NO3)2 van 10 g hebben en het volume ervan is 3,1 ml, dan is de dichtheid:
Dichtheid van Ba(NO3)2 = 10 / 3,1 = 3,23 g/ml
Bariumnitraat Moleculair gewicht
Het molecuulgewicht van Ba(NO3)2 is hetzelfde als de molaire massa, namelijk 261,337 g/mol. Het is de massa van één mol Ba(NO3)2-moleculen. Soms wordt de term molecuulgewicht door elkaar gebruikt met molmassa, maar ze zijn niet precies hetzelfde. Molecuulgewicht verwijst naar de gemiddelde massa van een molecuul van een stof, terwijl molaire massa verwijst naar de massa van een mol van een stof.
Structuur van bariumnitraat
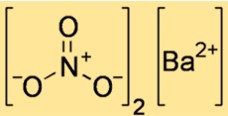
De structuur van Ba(NO3)2 laat zien hoe atomen en ionen in de ruimte zijn gerangschikt. Ba(NO3)2 is een ionische verbinding, wat betekent dat het bestaat uit positief geladen bariumionen en negatief geladen nitraationen die bij elkaar worden gehouden door elektrostatische krachten. De structuur van Ba(NO3)2 kan worden weergegeven door een eenheidscel, de kleinste herhalende eenheid die de rangschikking van ionen in een kristalrooster weergeeft.
Een eenheidscel van Ba(NO3)2 heeft een kubusvorm, met een bariumion op elke hoek en een nitraation in het midden van elk vlak. Het coördinatiegetal van elk ion is zes, wat betekent dat elk ion omgeven is door zes tegengesteld geladen ionen. De lengte van elke rand van de eenheidscel is 0,65 nm.
Oplosbaarheid van bariumnitraat
De Ba(NO3)2-oplosbaarheid is de hoeveelheid Ba(NO3)2 die kan oplossen in een bepaalde hoeveelheid oplosmiddel, meestal water. De oplosbaarheid is afhankelijk van verschillende factoren, zoals temperatuur, druk en de aanwezigheid van andere stoffen in de oplossing.
Bij 20°C en atmosferische druk bedraagt de oplosbaarheid van Ba(NO3)2 in water ongeveer 34 g per 100 ml. Dit betekent dat onder deze omstandigheden 34 g Ba(NO3)2 kan oplossen in 100 ml water. De oplosbaarheid neemt toe bij toenemende temperatuur en neemt af bij toenemende druk.
Ba(NO3)2 is ook oplosbaar in andere oplosmiddelen, zoals ethanol, aceton en methanol, maar minder oplosbaar dan in water.
| Verschijning | Witte vaste stof |
| Specifieke dichtheid | 3.23 |
| Kleur | Kleurloos, zilver of grijs |
| Geur | Geurloos |
| Molaire massa | 261.337 g/mol |
| Dikte | 3,23 g/ml |
| Fusie punt | 592°C |
| Kookpunt | 83°C |
| Flitspunt | Niet vlambaar |
| oplosbaarheid in water | 34 g per 100 ml bij 20°C |
| Oplosbaarheid | Oplosbaar in ethanol, aceton en methanol; onoplosbaar in ether en chloroform |
| Dampdruk | Verwaarloosbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Niet beschikbaar |
Veiligheid en gevaren van bariumnitraat
Ba(NO3)2 is een giftige en oxiderende stof. Het kan schadelijk voor u zijn als u het inslikt of inademt. Dit kan de ogen, huid en luchtwegen irriteren. Ba(NO3)2 kan ook spierspasmen, hartproblemen en de dood veroorzaken. U moet contact met Ba(NO3)2 vermijden en beschermende uitrusting dragen wanneer u ermee werkt. Houd het apparaat ook uit de buurt van hitte, vonken, vlammen en brandbare materialen. Als u wordt blootgesteld aan Ba(NO3)2, moet u uw ogen en huid met water spoelen en medische hulp inroepen. U kunt ook sulfaatzouten gebruiken om de bariumtoxiciteit te verminderen.
| Gevarensymbolen | O (oxidant), Xn (schadelijk) |
| Beveiligingsbeschrijving | S13: Verwijderd houden van eten en drinken, ook van dieren. S17: Verwijderd houden van brandbare materialen. S22: Stof niet inademen. S26: Bij aanraking met de ogen onmiddellijk met veel water afspoelen en een arts raadplegen. S36/37/39: Draag geschikte beschermende kleding, handschoenen en oog-/gezichtsbescherming. |
| VN-identificatienummers | VN1446 |
| HS-code | 2834 29 10 |
| Gevarenklasse | 5.1 (Oxiderende materialen) |
| Verpakkingsgroep | III |
| Toxiciteit | LD50 (oraal, rat) = 355 mg/kg; LC50 (inhalatie, rat) = 0,15 mg/l/4 uur |
Methoden voor de synthese van bariumnitraat
Er kunnen verschillende methoden worden gebruikt om Ba(NO3)2 te maken, een witte vaste stof.
Eén methode omvat het laten reageren van bariumcarbonaat met salpeterzuur . Hierbij ontstaat Ba(NO3)2 en kooldioxide. Filtreer de Ba(NO3)2-oplossing om eventuele ijzeronzuiverheden te verwijderen en damp deze vervolgens in om vaste kristallen te verkrijgen.
Een andere methode is om bariumsulfide te laten reageren met salpeterzuur . Hierbij ontstaan Ba(NO3)2 en waterstofsulfide. Om de Ba(NO3)2-oplossing te zuiveren en te kristalliseren volgen we hetzelfde proces als voorheen.
Een derde methode omvat het oplossen van bariummetaal of bariumoxide in salpeterzuur . Hierbij ontstaat Ba(NO3)2 en waterstof of water. De oplossing die Ba(NO3)2 bevat, wordt vervolgens geconcentreerd en ondergaat kristallisatie.
Een vierde methode is het gebruik van gesmolten zoutsynthese. Hierbij wordt een mengsel van Ba(NO3)2 en een anorganisch blaartrekkend middel, zoals ammoniumchloride, natriumbicarbonaat of natriumnitriet, verwarmd. Het blaartrekkende middel wordt afgebroken en creëert poriën in de Ba(NO3)2-kristallen. Dit maakt ze betrouwbaarder als pyrotechnische oxidatiemiddelen.
Hier zijn enkele methoden om Ba(NO3)2 te synthetiseren. Ze gebruiken allemaal salpeterzuur als gebruikelijk reagens en produceren Ba(NO3)2 als product.
Gebruik van bariumnitraat
Enkele toepassingen van Ba(NO3)2 zijn:
- Bariumoxideverbindingen – Gebruikt bij de productie van materialen die bariumoxide bevatten, zoals keramiek, glas en kathodestraalbuizen.
- Groene Vlam – Gebruikt in groene verkeerslichten en vuurwerk omdat het brandt met een groene vlam door de uitstoot van bariumionen.
- Rodenticide – Gebruikt als rodenticide om ratten en muizen te doden, omdat het giftig voor hen is.
- Oxidatiemiddel – Het wordt gebruikt in ontstekers en explosieven en is een krachtig oxidatiemiddel dat de verbranding van andere stoffen kan bevorderen.
- Primer – Wordt gebruikt in primers en tracerkogels omdat het zorgt voor ontsteking en zichtbaarheid van de munitie.
- Pigment – Gebruikt bij het maken van verven en pigmenten omdat het deze een witte of groene kleur kan geven.
- Oxidatiemiddel – Gebruikt als oxidatiemiddel bij verschillende chemische reacties, zoals de synthese van bariumperoxide en bariumhydroxide.
- Explosieven – Gebruikt bij de vervaardiging van explosieven zoals Baratol, een mengsel van Ba(NO3)2, TNT en bindmiddel.
Vragen:
Vraag: Is bariumnitraat oplosbaar?
A: Ba(NO3)2 is oplosbaar in water en enkele andere oplosmiddelen, zoals ethanol, aceton en methanol.
Vraag: Is bariumnitraat nuttig voor beton?
A: Ba(NO3)2 is niet bruikbaar voor beton, omdat het corrosie van stalen wapening en scheuren in beton kan veroorzaken.
Vraag: Zal er een neerslag ontstaan als oplossingen van kaliumsulfaat en bariumnitraat worden gecombineerd?
A: Ja, er zal zich een neerslag van bariumsulfaat (BaSO4) vormen als oplossingen van kaliumsulfaat (K2SO4) en bariumnitraat (Ba(NO3)2) worden gecombineerd.
Vraag: Bariumnitraat heeft de formule Ba(NO3)2. Welke bewering over bariumnitraat is waar?
A: Een mogelijke verklaring is: Ba(NO3)2 is een ionische verbinding die bestaat uit één bariumion en twee nitraationen.
Vraag: Is bariumnitraat vluchtig?
A: Nee, Ba(NO3)2 is niet vluchtig, omdat het een hoog smeltpunt heeft en ontleedt voordat het kookt.
Vraag: Is bariumnitraat neutraal?
A: Nee, Ba(NO3)2 is niet neutraal, omdat het een zuur zout is dat de pH van een oplossing kan verlagen.
Vraag: Wat ontstaat er bij de vervangingsreactie van Ba(NO3)2 en Na2SO4?
A: NaNO3 en BaSO4 worden geproduceerd tijdens de vervangingsreactie van Ba(NO3)2 en Na2SO4.
Vraag: Is Ba(NO3)2 oplosbaar in water?
A: Ja, Ba(NO3)2 is oplosbaar in water, omdat het oplost en bariumionen en nitraationen vormt.
Vraag: Wat is de netto ionische vergelijking voor de reactie van MgSO4 met Ba(NO3)2?
A: De netto ionische vergelijking voor de reactie van MgSO4 met Ba(NO3)2 is:
Ba2+ + SO42- → BaSO4
Vraag: Hoeveel mol zit er in 432 g Ba(NO3)2?
A: Het aantal mol in 432 g Ba(NO3)2 is:
n = m/M, n = 432/261.337, n = 1.653 mol
Vraag: Is Ba(NO3)2 oplosbaar?
A: Ja, Ba(NO3)2 is oplosbaar, omdat het oplost en bariumionen en nitraationen vormt.
