Ammoniumcarbonaat ((NH4)2CO3) is een zout. Het wordt gevormd wanneer ammoniak en kooldioxide reageren. Het heeft vele toepassingen, zoals bak- en geurzout.
| Naam van IUPAC | Ammoniumcarbonaat |
| Moleculaire formule | (NH4)2CO3 |
| CAS-nummer | 506-87-6 |
| Synoniemen | bakkersammoniak, vluchtig zout, hartshoornzout, E503 |
| InChi | InChI=1S/CH2O3.2H3N/c2-1(3)4;;/h(H2,2,3,4);2*1H3 |
Eigenschappen van ammoniumcarbonaat
Ammoniumcarbonaatformule
De chemische formule of molecuulformule van ammoniumcarbonaat is (NH4)2CO3 1 . Het is een zout dat bestaat uit twee ammoniumionen en één carbonaation. Je kunt NH4+ + NH4+ + CO3 2- schrijven om de ladingen van de ionen weer te geven.
Ammoniumcarbonaat Molaire massa
De molaire massa van (NH4)2CO3 is 96,09 g/mol 2 . Om de molaire massa te berekenen, moeten we de atoommassa’s van alle atomen in de formule bij elkaar optellen. De atoommassa’s zijn:
- Stikstof: 14,01 g/mol
- Waterstof: 1,01 g/mol
- Koolstof: 12,01 g/mol
- Zuurstof: 16,00 g/mol
De molaire massa van ammoniumcarbonaat is dus:
(2 x 14,01) + (8 x 1,01) + 12,01 + (3 x 16,00) = 96,09 g/mol
Kookpunt van ammoniumcarbonaat
(NH4)2CO3 heeft geen kookpunt omdat het ontleedt voordat het deze temperatuur bereikt. Bij verhitting valt het uiteen in ammoniak en kooldioxide, die uit de vaste stof ontsnappen. De ontledingsreactie is:
(NH4)2CO3 -> 2NH3 + CO2 + H2O
De ontledingstemperatuur is afhankelijk van de vochtigheid en druk van de omgeving, maar ligt doorgaans rond de 60°C.
Ammoniumcarbonaat Smeltpunt
(NH4)2CO3 heeft een smeltpunt van 58°C (136°F; 331 K). Het ontleedt echter ook bij deze temperatuur en vormt daarom geen vloeibare fase. In plaats daarvan sublimeert het rechtstreeks van vast naar gas.
Dichtheid van ammoniumcarbonaat g/ml
De dichtheid van (NH4)2CO3 bedraagt 1,50 g/ml. Dichtheid is de massa per volume-eenheid van een stof. Om de dichtheid te berekenen, deelt u de massa door het volume. Als we bijvoorbeeld 10 g (NH4)2CO3 hebben en dit neemt 6,67 ml ruimte in beslag, dan is de dichtheid:
10 g / 6,67 ml = 1,50 g/ml
Ammoniumcarbonaat Molecuulgewicht
Het molecuulgewicht van (NH4)2CO3 is hetzelfde als de molaire massa, namelijk 96,09 g/mol. Molecuulgewicht en molaire massa worden vaak door elkaar gebruikt, maar ze hebben enigszins verschillende betekenissen. Het molecuulgewicht is de massa van één molecuul van een stof, terwijl de molaire massa de massa is van één mol (6,022 x 10^23 moleculen) van een stof.
Structuur van ammoniumcarbonaat
De structuur van (NH4)2CO3 kan worden weergegeven door een Lewis-puntenstructuur of een ball-and-stick-model. Een Lewis-puntstructuur toont de valentie-elektronen van elk atoom en hoe deze worden gedeeld of overgedragen om bindingen te vormen. Een bal-en-stokmodel toont de vorm en rangschikking van atomen en bindingen in drie dimensies.
Hier is een mogelijke Lewis-puntstructuur voor ammoniumcarbonaat:
OOOO
|| || ||
HNH HNH HCH
| | |
HHH
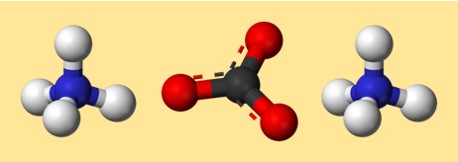
Hier is een mogelijk model voor ammoniumcarbonaat:
In dit model vertegenwoordigt elke kleur een ander element:
- Grijs: koolstof
- Rood: zuurstof
- Blauw: stikstof
- Wit: waterstof
Oplosbaarheid van ammoniumcarbonaat
(NH4)2CO3 is oplosbaar in water. Oplosbaarheid is het vermogen van een stof om op te lossen in een andere stof. Wanneer (NH4)2CO3 oplost in water, vormt het waterige ionen die kunnen interageren met andere ionen of moleculen in oplossing. De oplossingsreactie is:
(NH4)2CO3 + H2O -> 2 NH4+ + CO3 2- + H2O
De oplosbaarheid van (NH4)2CO3 is afhankelijk van de temperatuur en pH van het water. Bij hogere temperaturen kan er meer (NH4)2CO3 in water oplossen.
| Verschijning | wit poeder |
| Specifieke dichtheid | 1,50 |
| Kleur | Kleurloos |
| Geur | Scherpe geur van ammoniak |
| Molaire massa | 96,09 g/mol |
| Dikte | 1,50 g/ml |
| Fusie punt | 58°C (331K; 136°F) |
| Kookpunt | Breekt af voordat het kookt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 100g/100ml (15°C) |
| Oplosbaarheid | Oplosbaar in water, alcohol en aceton |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | 9,25 (voor NH4+) |
| pH | 7,8 (voor een oplossing van 0,1 M) |
Veiligheid en gevaren van ammoniumcarbonaat
(NH4)2CO3 is een gevaarlijke stof die irritatie en schade aan de huid, ogen, neus, keel en longen kan veroorzaken. Het kan ook schadelijk zijn bij inslikken. Er moet voorzichtig mee worden omgegaan en met persoonlijke beschermingsmiddelen, zoals handschoenen, een veiligheidsbril en maskers. Het moet worden opgeslagen in een koele, droge, goed geventileerde ruimte, uit de buurt van hitte, vonken en vlammen. Het mag niet worden gemengd met sterke zuren, basen of reductiemiddelen, omdat het heftig kan reageren of giftige gassen kan vrijkomen. Bij blootstelling dient u onmiddellijk medische hulp in te roepen.
| Gevarensymbolen | Xi (irriterend) |
| Beveiligingsbeschrijving | S22: Stof niet inademen. S24/25: Vermijd contact met huid en ogen. |
| VN-identificatienummers | UN3077 |
| HS-code | 28369910 |
| Gevarenklasse | 9 |
| Verpakkingsgroep | III |
| Toxiciteit | Orale LD50 rat: 2000 mg/kg |
Synthesemethoden voor ammoniumcarbonaat
Verschillende methoden kunnen (NH4)2CO3 synthetiseren, afhankelijk van de materialen waarmee ze beginnen en de gewenste zuiverheid van het product. Hier zijn enkele voorbeelden van methoden voor het synthetiseren van (NH4)2CO3:
- Eén methode omvat het laten reageren van ammoniumsulfaat met ammoniumchloride en calciumcarbonaat in een oven. Bij de reactie ontstaan (NH4)2CO3 en calciumchloride als bijproducten. De reactie luidt:
(NH4)2SO4 + 2 NH4Cl + CaCO3 -> 2 (NH4)2CO3 + CaCl2
- Een andere methode omvat het reageren met kooldioxide en ammoniak in een waterige oplossing. Bij de reactie ontstaan (NH4)2CO3 en water als bijproducten. De reactie luidt:
CO2 + 2 NH3 + H2O -> (NH4)2CO3 + H2O
- Een derde methode omvat het blootstellen van een ammoniumoplossing aan lucht die kooldioxide bevat. Ammoniumbicarbonaat is het product van de reactie en door verhitting kan het verder worden afgebroken tot (NH4)2CO3.
De reacties zijn:
NH3 + CO2 + H2O -> NH4HCO3
NH4HCO3 -> NH3 + CO2 + H2O
(NH4)2CO3 -> (NH4)2CO3
- Blootstelling van ammoniumbicarbonaat aan lucht produceert (NH4)2CO3 voor commercieel gebruik. Ammoniumbicarbonaat valt uiteen in ammoniak en kooldioxide, die weer reageren en (NH4)2CO3 vormen. Het proces is:
NH4HCO3 -> NH3 + CO2
NH3 + CO2 -> (NH4)2CO3
Gebruik van ammoniumcarbonaat
(NH4)2CO3 heeft verschillende toepassingen op verschillende gebieden, zoals:
- Bakkers gebruiken het als rijsmiddel, vooral voor platte of knapperige koekjes en crackers. Het produceert koolstofdioxide en ammoniakgassen die het deeg helpen rijzen en een lichte textuur creëren. Het verbetert ook de smaak en het aroma van gebak.
- Mensen gebruiken het als reukzout om mensen die flauwgevallen zijn of zich ongelukkig voelen weer tot leven te wekken. Het stimuleert het ademhalingssysteem en verhoogt de bloeddruk door ammoniakdampen vrij te geven die de neus en longen irriteren.
- Sommige hoestsiropen en slijmoplossende middelen, zoals Buckley’s hoestsiroop, gebruiken het als actief ingrediënt. Het helpt slijm uit de borst en keel los te maken en te verdrijven door de slijmafscheiding te vergroten.
- Artsen gebruiken het als braakmiddel om braken op te wekken in geval van vergiftiging of overdosis. Het irriteert de maagwand en veroorzaakt misselijkheid en braken door kooldioxide vrij te geven.
- Chemici gebruiken het als reagens bij sommige chemische reacties, zoals de synthese van ureum, ammoniumnitraat en ammoniumsulfaat. Het fungeert ook als buffer om de pH van oplossingen te handhaven.
Vragen:
Vraag: Is ammoniumcarbonaat zuur of basisch?
A: (NH4)2CO3 is een zout dat kan reageren met zowel zuren als basen. Wanneer het oplost in water, vormt het ammoniumionen en carbonaationen. Ammoniumionen kunnen fungeren als zwakke zuren en protonen doneren aan water, terwijl carbonaationen kunnen fungeren als zwakke basen en protonen uit water kunnen accepteren. De pH van de oplossing hangt af van de relatieve sterkte van de ammoniumionen en carbonaationen. Als carbonaationen sterkere basen zijn dan ammoniumionen zuren, zal de oplossing basisch zijn. De oplossing zal zuur zijn als de ammoniumionen sterkere zuren zijn dan de carbonaationen basen. Als de ammoniumionen en carbonaationen vergelijkbare sterktes hebben, zal de oplossing neutraal zijn.
Vraag: Is ammoniumcarbonaat een zout?
A: Ja, (NH4)2CO3 is een zout. Een zout is een verbinding die ontstaat wanneer een zuur en een base elkaar neutraliseren. (NH4)2CO3 kan ontstaan wanneer ammoniak, een zwakke base, reageert met koolzuur, een zwak zuur. De reactie luidt:
2NH3 + H2CO3 -> (NH4)2CO3 + H2O
Ammoniak en koolzuur zijn de basisbase en het zuur van (NH4)2CO3.
Vraag: Heeft ammoniumcarbonaat (aq) een geur in waterige vorm?
A: Ja, (NH4)2CO3 (aq) heeft een geur in waterige vorm. De geur wordt veroorzaakt door het vrijkomen van ammoniakgas uit de oplossing. Ammoniakgas heeft een scherpe geur die de neus en longen kan irriteren. Ammoniakgas kan uit de oplossing ontsnappen omdat het vluchtig is en een lage oplosbaarheid in water heeft. De hoeveelheid vrijkomend ammoniakgas is afhankelijk van de temperatuur en concentratie van de oplossing.
Vraag: Welk type atoom is ammoniumcarbonaat?
A: (NH4)2CO3 is geen atoom, maar een molecuul. Een molecuul is een groep atomen die met elkaar verbonden zijn door elektronen te delen. Een atoom is de kleinste eenheid van materie met een gedefinieerde chemische identiteit. (NH4)2CO3 is een molecuul dat bestaat uit vier verschillende soorten atomen: stikstof, waterstof, koolstof en zuurstof. De molecuulformule van (NH4)2CO3 is (NH4)2CO3.
Vraag: Hoeveel mol zit er in ammoniumcarbonaat?
A: Om deze vraag te kunnen beantwoorden, moeten we weten hoeveel (NH4)2CO3 we hebben in termen van massa of volume. Een mol is een meeteenheid die 6,022 x 10^23 deeltjes van een stof vertegenwoordigt. Het aantal mol van een stof kan worden berekend door de massa te delen door de molaire massa of door het volume te vermenigvuldigen met de molariteit. De molaire massa van (NH4)2CO3 is 96,09 g/mol. De molariteit van (NH4)2CO3 hangt af van de oplossing ervan in water.
Als we bijvoorbeeld 10 g (NH4)2CO3 hebben, kunnen we het aantal mol vinden door 10 g te delen door 96,09 g/mol:
10 g / 96,09 g/mol = 0,104 mol
Als we 100 ml 0,1 M (NH4)2CO3-oplossing hebben, kunnen we het aantal mol vinden door 100 ml te vermenigvuldigen met 0,1 mol/L:
100 ml x 0,1 mol/l = 0,01 mol
Vraag: Wat is de chemische formule van ammoniumcarbonaat?
A: De chemische formule voor ammoniumcarbonaat is (NH4)2CO3. Deze formule laat zien dat een molecuul (NH4)2CO3 twee ammoniumionen (NH4+) en één carbonaation (CO3 2-) bevat. De ladingen op de ionen zijn in evenwicht, dus de totale lading op het molecuul is nul.
Vraag: Hoeveel mol ammoniumionen zitten er in 6,995 g ammoniumcarbonaat?
A: Om deze vraag te beantwoorden, moeten we twee stappen volgen:
- Eerst moeten we bepalen hoeveel mol (NH4)2CO3 er in 6,995 g zit, door 6,995 g te delen door de molaire massa (96,09 g/mol):
6,995 g / 96,09 g/mol = 0,0728 mol
- Ten tweede moeten we dit getal met twee vermenigvuldigen, omdat elke mol (NH4)2CO3 twee mol ammoniumionen bevat:
0,0728 mol x 2 = 0,1456 mol
Er zitten dus 0,1456 mol ammoniumionen in 6,995 g (NH4)2CO3.
Vraag: Welk gas ontstaat wanneer zoutzuur reageert met ammoniumcarbonaat?
A: Wanneer zoutzuur reageert met (NH4)2CO3, ondergaan ze een dubbele verdringingsreactie om ammoniumchloride en koolzuur te produceren. Het koolzuur valt vervolgens uiteen in water en kooldioxide. Kooldioxide is het gas dat bij deze reactie ontstaat. De algemene vergelijking voor deze reactie is als volgt:
(NH4)2CO3 + 2 HCl -> 2 NH4Cl + H2CO3
H2CO3 -> H2O + CO2
De netto ionische vergelijking voor deze reactie is:
CO3 2- + 2 H+ -> H2O + CO2
