Trimethylamine (TMA) is een verbinding met een sterke visgeur. Het wordt aangetroffen in vis, rottende visproducten en menselijk zweet. Dit kan een slechte adem en lichaamsgeur veroorzaken.
| IUPAC-naam | N,N-Dimethylmethaanamine |
| Moleculaire formule | C3H9N |
| CAS-nummer | 75-50-3 |
| Synoniemen | TMA, dimethylamine, methyldimethylamine, N,N-dimethylamine, tertiair methylamine, tertiair methylamine |
| InChi | InChI=1S/C3H9N/c1-4(2)3/h1-3H3 |
Eigenschappen van trimethylamine
Trimethylamine-formule
De chemische formule voor trimethylamine is C3H9N, wat aangeeft dat het molecuul drie koolstofatomen, negen waterstofatomen en één stikstofatoom bevat. De formule kan worden gebruikt om het molecuulgewicht en andere eigenschappen van trimethylamine te berekenen.
Trimethylamine Molaire Massa
De molaire massa van TMA is 59,11 g/mol. Deze waarde wordt berekend door de atoommassa’s van alle atomen in het molecuul op te tellen. Molaire massa is een belangrijke parameter die wordt gebruikt bij chemische berekeningen, met name voor het bepalen van de stoichiometrie en het aantal mol van een stof.
Kookpunt van trimethylamine
Het kookpunt van TMA is -6,9°C of 19,6°F. Dit is een relatief laag kookpunt, wat betekent dat de verbinding vluchtig is en gemakkelijk kan verdampen. TMA kan vloeibaar worden gemaakt door druk uit te oefenen en wordt vaak in gasvorm gebruikt in verschillende toepassingen.
Smeltpunt van trimethylamine
Het smeltpunt van TMA is -117,3°C of -179,1°F. Dit is een zeer laag smeltpunt, wat betekent dat de verbinding meestal bij kamertemperatuur in vloeibare of gasvormige toestand wordt aangetroffen. Het kan worden gestold door af te koelen tot temperaturen onder het smeltpunt.
Dichtheid van trimethylamine g/ml
De dichtheid van TMA is 0,692 g/ml bij kamertemperatuur. Deze waarde wordt gebruikt om de massa van TMA per volume-eenheid te bepalen. De dichtheid van de verbinding is relatief laag in vergelijking met andere vloeistoffen, waardoor deze minder dicht is dan water.
Trimethylamine Molecuulgewicht
Het molecuulgewicht van TMA is 59,11 g/mol. Deze waarde is de som van de atoomgewichten van alle atomen in het molecuul. Het molecuulgewicht wordt gebruikt om de hoeveelheid van een stof te berekenen die nodig is voor een specifieke chemische reactie of proces.
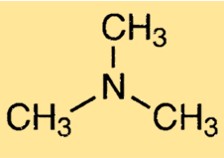
Structuur van trimethylamine
TMA heeft een piramidale moleculaire geometrie, met een trigonale piramidevorm rond het stikstofatoom. Het molecuul heeft een centraal stikstofatoom gekoppeld aan drie methylgroepen. Het stikstofatoom heeft een paar niet-bindende elektronen, wat bijdraagt aan de karakteristieke geur van het molecuul.
Oplosbaarheid van trimethylamine
TMA is oplosbaar in water en organische oplosmiddelen, waaronder ethanol, ether en aceton. De oplosbaarheid van TMA in water is 1,8 g/100 ml bij 25°C. De verbinding is vanwege zijn polaire aard zeer oplosbaar in polaire oplosmiddelen, waardoor deze bruikbaar is in diverse industriële toepassingen.
| Verschijning | Kleurloos gas met een sterke visgeur |
| Soortelijk gewicht | 0,692 bij 25°C |
| Kleur | Kleurloos |
| Geur | Sterke visgeur |
| Molaire massa | 59,11 g/mol |
| Dikte | 0,692 g/ml bij 25°C |
| Fusie punt | -117,3°C of -179,1°F |
| Kookpunt | -6,9°C of 19,6°F |
| Flitspunt | -20°C |
| oplosbaarheid in water | Oplosbaar |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen |
| Dampdruk | 542 mmHg bij 20°C |
| Dampdichtheid | 2,1 bij 25°C |
| pKa | 9.79 |
| pH | Alkalisch |
Veiligheid en gevaren van trimethylamine
TMA brengt verschillende veiligheidsrisico’s met zich mee, voornamelijk vanwege de licht ontvlambare aard en de sterke visgeur. Het is door verschillende regelgevende instanties, waaronder de United States Environmental Protection Agency (EPA), geclassificeerd als een gevaarlijke stof. Blootstelling aan TMA kan huid- en oogirritatie, ademhalingsproblemen en misselijkheid veroorzaken. Het is ook giftig als het in grote hoeveelheden wordt ingenomen of ingeademd. Bij het hanteren van TMA moeten passende voorzorgsmaatregelen worden genomen, waaronder het dragen van geschikte beschermende uitrusting en het zorgen voor voldoende ventilatie. Bij blootstelling moet onmiddellijk medische hulp worden ingeroepen.
| Gevarensymbolen | Ontvlambaar, corrosief |
| Beveiligingsbeschrijving | Uit de buurt houden van hitte, vonken en open vuur. Vermijd het inademen van gas. Alleen gebruiken bij voldoende ventilatie. Draag geschikte beschermende uitrusting. |
| VN-identificatienummers | VN1083 |
| HS-code | 29211900 |
| Gevarenklasse | 2.1 – Ontvlambare gassen |
| Verpakkingsgroep | PG ik |
| Toxiciteit | Giftig bij inslikken of inademen van grote hoeveelheden. Veroorzaakt huid- en oogirritatie, ademhalingsproblemen en misselijkheid. |
Methoden voor de synthese van trimethylamine
Er zijn verschillende methoden om TMA te synthetiseren, maar de meest voorkomende is de reactie van formaldehyde met ammoniumchloride in aanwezigheid van calciumhydroxide . We kennen dit proces als de Eschweiler-Clarke-reactie.
Een andere methode omvat de reactie van dimethylamine met formaldehyde , gevolgd door hydrogenering in aanwezigheid van een katalysator. We noemen deze methode de Leuckart-Wallach-reactie.
De Frankland-reactie produceert TMA wanneer natrium- of kaliumhydroxide aanwezig is tijdens de reactie van ammoniak met trimethylboraat.
TMA kan worden geproduceerd door methyljodide te laten reageren met ammoniak en het vervolgens te reduceren met zinkstof. Chemici noemen deze methode Hofmann-degradatie.
Andere, minder gebruikelijke methoden voor het synthetiseren van TMA zijn onder meer het laten reageren van trimethylfosfiet met ammoniak, het laten reageren van TMA-oxide met zuur en het laten reageren van trimethylaluminium met ammoniak .
Over het algemeen vereist de synthese van TMA een zorgvuldige omgang met reactieve en potentieel gevaarlijke chemicaliën, evenals expertise op het gebied van organische chemie.
Gebruik van trimethylamine
TMA wordt op verschillende manieren gebruikt in verschillende industrieën vanwege de unieke chemische eigenschappen, waaronder de sterke en duidelijke geur. Hier zijn enkele van de meest voorkomende toepassingen van TMA:
- Productie van pesticiden: Gebruikt bij de productie van verschillende pesticiden, waaronder chloorpyrifos en diazinon.
- Organische synthese: Organische chemici gebruiken TMA op grote schaal om quaternaire ammoniumzouten te synthetiseren, die vanwege hun uitzonderlijke eigenschappen brede toepassingen vinden in verschillende industrieën.
- Gasbehandeling: Gebruikt om zure gassen, zoals kooldioxide en waterstofsulfide, uit aardgas en aardolieproducten te verwijderen.
- Farmaceutische industrie: gebruikt bij de productie van verschillende farmaceutische producten, waaronder het antidiabeticum metformine en het lokale anestheticum procaïne.
- Voedingsindustrie: TMA veroorzaakt de visgeur die in sommige zeevruchten wordt aangetroffen en voegt als smaakstof smaak toe aan sommige voedingsproducten.
- Laboratoriumonderzoek: Wordt ook gebruikt bij laboratoriumonderzoek, voornamelijk bij de studie van eiwitstructuren.
Vragen:
Vraag: Wat is de chemische formule van het trimethylaminebaseconjugaatzuur (CH3) 3N?
A: De chemische formule voor het geconjugeerde zuur van TMA is (CH3)3NH+.
Vraag: De pH van 0,050 M waterig trimethylamine is 11,24. Wat is de KB van deze basis?
A: De Kb van TMA kan worden berekend met behulp van de pH van de oplossing, die 11,24 is. De KB-waarde is 1,8 x 10^-5.
Vraag: Wat is de initiële concentratie trimethylamine in water?
A: De initiële concentratie van TMA in water hangt af van de specifieke gebruikte oplossing. Zonder aanvullende informatie is het onmogelijk om de initiële concentratie te bepalen.
Vraag: Is trimethylamine een sterke base?
A: TMA is een zwakke base omdat het slechts gedeeltelijk dissocieert in een waterige oplossing.
Vraag: Is trimethylamine polair?
A: Ja, TMA is een polair molecuul vanwege de aanwezigheid van een stikstofatoom met een paar vrije elektronen en drie methylgroepen.
Vraag: Is trimethylamine een zuur of een base?
A: TMA is een base omdat het een proton van een zuur accepteert om zijn conjugaatzuur te vormen.
Vraag: Veroorzaakt trimethylamine spanningscorrosie in koolstofstaal?
A: Ja, TMA kan onder bepaalde omstandigheden spanningscorrosie in koolstofstaal veroorzaken.
Vraag: Waarvoor wordt trimethylamine gebruikt bij HPLC?
A: TMA wordt gebruikt als additief voor de mobiele fase bij HPLC om de piekvorm en scheiding van basische verbindingen te verbeteren.
Vraag: Wat is een sterkere base, trimethylamine of pyridine?
A: Pyridine is een sterkere base dan TMA omdat het stikstofatoom deel uitmaakt van een aromatische ring, die het resulterende conjugaatzuur stabiliseert.
