Tetrachloorethyleen (C2Cl4) is een kleurloze, niet-ontvlambare vloeistof die vaak wordt gebruikt bij chemisch reinigen. Het kan gezondheidsproblemen veroorzaken zoals duizeligheid, hoofdpijn en leverschade als het overmatig wordt ingenomen of ingeademd.
| IUPAC-naam | Tetrachlooretheen |
| Moleculaire formule | C2Cl4 |
| CAS-nummer | 127-18-4 |
| Synoniemen | Perchloorethyleen, PCE, tetrachlooretheen, tetrachloorkoolstofdimeer, 1,1,2,2-tetrachloorethyleen |
| InChi | InChI=1S/C2Cl4/c3-1(4)2(5)6 |
Eigenschappen van tetrachloorethyleen
Tetrachloorethyleen-formule
Tetrachloorethyleen, ook bekend als perchloorethyleen of PCE, heeft de chemische formule C2Cl4. Dit betekent dat elk tetrachloorethyleenmolecuul bestaat uit twee koolstofatomen en vier chlooratomen. De formule is belangrijk omdat deze ons helpt de moleculaire structuur en eigenschappen van tetrachloorethyleen te begrijpen.
Tetrachloorethyleen Molaire massa
De molaire massa van C2Cl4 is 165,83 g/mol. Dit betekent dat één mol C2Cl4, wat gelijk is aan 6,022 x 10^23 moleculen, 165,83 gram weegt. Molaire massa is belangrijk bij chemische berekeningen en kan helpen bepalen hoeveel C2Cl4 nodig is voor een specifieke reactie.
Kookpunt van tetrachloorethyleen
Het kookpunt van C2Cl4 is 121,1°C (250°F). Dit betekent dat C2Cl4 bij een temperatuur van 121,1°C verandert van een vloeistof naar een gas. Het kookpunt is een belangrijke eigenschap omdat het van invloed is op hoe C2Cl4 zich in verschillende omgevingen gedraagt.
Tetrachloorethyleen Smeltpunt
Het smeltpunt van C2Cl4 is -22,94°C (-9,31°F). Dit betekent dat bij een temperatuur lager dan -22,94°C C2Cl4 zal veranderen van vast naar vloeibaar. Het smeltpunt is belangrijk bij het bepalen van de fysieke toestand van C2Cl4 bij verschillende temperaturen.
Tetrachloorethyleen Dichtheid g/ml
De dichtheid van C2Cl4 is 1,62 g/ml bij kamertemperatuur. Dit betekent dat C2Cl4 een hogere dichtheid heeft dan water, dat een dichtheid heeft van 1 g/ml. Dichtheid is belangrijk voor het begrijpen van de fysieke eigenschappen van C2Cl4 en hoe het zich in verschillende omgevingen gedraagt.
Tetrachloorethyleen Molecuulgewicht
Het molecuulgewicht van C2Cl4 bedraagt 165,83 g/mol. Dit betekent dat het gewicht van één C2Cl4-molecuul 165,83 atomaire massa-eenheden is. Het molecuulgewicht is belangrijk bij chemische berekeningen en kan helpen bij het bepalen van de hoeveelheid C2Cl4 die nodig is voor een specifieke reactie.
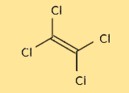
Structuur van tetrachloorethyleen
De structuur van C2Cl4 bestaat uit twee koolstofatomen en vier chlooratomen, gerangschikt in een tetraëdrische vorm. De koolstofatomen zijn verbonden door een dubbele binding, terwijl elk chlooratoom gebonden is aan een van de koolstofatomen. De structuur is belangrijk voor het begrijpen van de chemische en fysische eigenschappen van C2Cl4.
Oplosbaarheid van tetrachloorethyleen
C2Cl4 is onoplosbaar in water, maar wel oplosbaar in organische oplosmiddelen zoals alcohol en ether. Dit betekent dat C2Cl4 niet in water oplost, maar wel in andere stoffen. Oplosbaarheid is belangrijk voor het begrijpen van het gedrag van C2Cl4 in verschillende omgevingen, zoals in industriële omgevingen of in het laboratorium.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 1,62 bij 20°C |
| Kleur | Kleurloos |
| Geur | Zoete en etherische geur |
| Molaire massa | 165,83 g/mol |
| Dikte | 1,62 g/ml bij 20°C |
| Fusie punt | -22,94°C |
| Kookpunt | 121,1°C |
| Flitspunt | 55°C |
| oplosbaarheid in water | 0,015 g/100 ml bij 25°C |
| Oplosbaarheid | Oplosbaar in alcohol en ether |
| Dampdruk | 10 mmHg bij 20°C |
| Dampdichtheid | 5.7 |
| pKa | 1.8 |
| pH | Niet van toepassing (zuivere stof) |
Veiligheid en gevaren van tetrachloorethyleen
C2Cl4 kan schadelijk zijn bij inademing, inslikken of bij contact met de huid of ogen. Dit kan duizeligheid, hoofdpijn, verwarring en irritatie van de luchtwegen veroorzaken. Langdurige blootstelling kan leiden tot lever- en nierschade en het risico op bepaalde vormen van kanker vergroten. Het is belangrijk om voorzichtig om te gaan met C2Cl4 en geschikte beschermende uitrusting te gebruiken wanneer u ermee werkt. De stof moet worden opgeslagen in een goed geventileerde ruimte en uit de buurt van hitte- of ontstekingsbronnen worden gehouden. Gemorst materiaal moet onmiddellijk worden opgeruimd en op de juiste wijze worden afgevoerd in overeenstemming met de plaatselijke regelgeving.
| Gevarensymbolen | Schedel en gekruiste knekels, vlam |
| Beveiligingsbeschrijving | Licht ontvlambaar, Giftig bij inademing of inslikken, Kan kanker veroorzaken, Kan orgaanschade veroorzaken |
| EEN ID | Een 1897 |
| HS-code | 290323 |
| Gevarenklasse | 6.1 (giftige stoffen) |
| Verpakkingsgroep | III |
| Toxiciteit | Tetrachloorethyleen is door het Internationaal Agentschap voor Kankeronderzoek (IARC) geclassificeerd als een kankerverwekkende stof uit groep 2A (waarschijnlijk kankerverwekkend voor de mens) en door de Europese Unie als een voortplantingstoxine uit categorie 2. |
Methoden voor de synthese van tetrachloorethyleen
Om C2Cl4 te synthetiseren kunnen verschillende methoden worden gebruikt, zoals directe chlorering van ethyleen , chlorering van ethyleendichloride of chlorering van tetrachloorkoolstof.
Ethyleengas reageert met chloorgas in een reactor en vormt C2Cl4 tijdens de directe chloreringsmethode. Deze methode kan hoge opbrengsten aan C2Cl4 opleveren, maar vereist een zorgvuldige controle van de reactieomstandigheden om ongewenste bijproducten te vermijden.
De tweede methode omvat de chlorering van ethyleendichloride, een bijproduct van de productie van vinylchloride. Deze methode levert ook hoge opbrengsten aan C2Cl4 op, maar kan resulteren in de vorming van giftige bijproducten zoals hexachloorbutadieen.
De derde methode omvat de chlorering van tetrachloorkoolstof, waarbij C2Cl4 als bijproduct kan ontstaan. Deze methode is echter minder efficiënt en levert lagere opbrengsten op dan de andere twee methoden.
Naast deze methoden is het ook mogelijk om C2Cl4 te produceren door trichloorethyleen te laten reageren met chloorgas of hexachloorethaan te laten reageren met fosgeen.
Op industriële schaal gebruiken fabrikanten gewoonlijk directe ethyleenchlorering en ethyleendichloridechlorering als de meest gebruikte methoden om C2Cl4 te produceren.
Gebruik van tetrachloorethyleen
C2Cl4 heeft verschillende industriële en commerciële toepassingen, waaronder:
- Stomerij: Wordt veel gebruikt als oplosmiddel voor het stomen van kleding vanwege het vermogen om een breed scala aan vlekken en vuil op te lossen.
- Metaalontvetten: Een effectief oplosmiddel voor het verwijderen van olie en vet van metalen oppervlakken, waardoor het nuttig is in de metaalverwerkende industrie.
- Kleefstoffen en afdichtingsmiddelen: Wordt gebruikt als oplosmiddel bij de vervaardiging van lijmen en afdichtingsmiddelen, omdat het vele soorten polymeren en harsen kan oplossen.
- Chemische tussenproducten: gebruikt als grondstof bij de productie van andere chemicaliën, zoals gechloreerde oplosmiddelen en fluorkoolwaterstoffen.
- Textiel- en leerverwerking: Wordt gebruikt bij de textiel- en leerverwerking als oplosmiddel en om onzuiverheden te verwijderen.
- Koelmiddel: Sommige toepassingen gebruiken C2Cl4 als koelmiddel, maar milieuoverwegingen zorgen ervoor dat dit gebruik geleidelijk wordt stopgezet.
- Laboratoriumoplosmiddel: Wordt ook gebruikt als laboratoriumoplosmiddel, vooral voor chromatografie- en spectroscopietoepassingen.
Vragen:
Vraag: Wat is tetrachloorethyleen?
A: C2Cl4, ook bekend als perchloorethyleen of PCE, is een kleurloze vloeistof met een milde geur die veel wordt gebruikt als oplosmiddel in verschillende industriële en commerciële toepassingen.
Vraag: Zal tetrachloorethyleen op water drijven?
A: Nee, C2Cl4 heeft een hogere dichtheid dan water, dus het zal zinken en een aparte laag op de bodem vormen.
Vraag: Waar kan ik tetrachloorethyleen (perchloorethyleen) stomerijoplosmiddel kopen?
A: C2Cl4 is een gereguleerde stof en kan alleen worden gekocht door erkende professionals in de stomerijbranche. Het wordt meestal gekocht bij chemische leveranciers of distributeurs die gespecialiseerd zijn in industriële oplosmiddelen.
Vraag: Wat is de relatie tussen tetrachloorethyleen en tetrachloorkoolstof?
A: C2Cl4 en tetrachloorkoolstof zijn beide gehalogeneerde koolwaterstoffen die chlooratomen bevatten, maar ze hebben verschillende structuren en moleculaire eigenschappen. Koolstoftetrachloride is een niet-polair molecuul, terwijl C2Cl4 polair is vanwege de aanwezigheid van een dubbele binding tussen twee koolstofatomen.
Vraag: Tetrachloorethyleen in water?
A: C2Cl4 is slechts in geringe mate oplosbaar in water en heeft de neiging zich te verdelen in bodem en sediment, waardoor het een veel voorkomende verontreiniging van grondwater en bodem is.
Vraag: Testbedrijven voor tetrachloorethyleen?
A: Veel milieutestbedrijven bieden C2Cl4-testdiensten aan voor water-, bodem- en luchtmonsters. Enkele voorbeelden zijn ALS Global, Eurofins TestAmerica en Environmental Testing and Consulting, Inc.
Vraag: Wat is hybridisatie van C-atomen in C2Cl4?
A: De C-atomen in C2Cl4 hebben sp2-hybridisatie, wat betekent dat ze drie hybride orbitalen hebben die betrokken zijn bij binding met andere atomen.
Vraag: Wat is bij benadering de hoek van de chloor-koolstof-chloorbinding in C2Cl4?
A: De geschatte hoek van de chloor-koolstof-chloorbinding in C2Cl4 is 120 graden, wat kenmerkend is voor moleculen met een trigonale vlakke geometrie.
Vraag: Is C2Cl4 polair of niet-polair?
A: C2Cl4 is een polair molecuul vanwege de aanwezigheid van een dubbele binding tussen de koolstofatomen, wat resulteert in een asymmetrische ladingsverdeling en een dipoolmoment.
