1-Butanol (C4H9OH) is een kleurloze alcohol met een licht zoete geur. Het wordt gebruikt als oplosmiddel, bij organische synthese en als brandstofbron. Het kan ook worden gebruikt in cosmetische en persoonlijke verzorgingsproducten.
| IUPAC-naam | Butaan-1-ol |
| Moleculaire formule | C4H10O |
| CAS-nummer | 71-36-3 |
| Synoniemen | n-butylalcohol, butanol, butylalcohol, 1-butylalcohol, 1-butanol, butanoleen, butyleenhydraat, butylhydraat |
| InChi | InChI=1S/C4H10O/c1-2-3-4-5/h5H,2-4H2,1H3 |
Eigenschappen van 1-butanol
Formule 1-Butanol
De molecuulformule van 1-butanol is C4H10O. Dit betekent dat het vier koolstofatomen, tien waterstofatomen en één zuurstofatoom bevat. Het heeft een lineaire structuur, waarbij de hydroxylgroep (-OH) aan het eerste koolstofatoom is bevestigd.
1-Butanol Molaire massa
De molaire massa van C4H9OH is 74,12 g/mol. Dit betekent dat één mol C4H9OH 74,12 gram weegt. Molaire massa is een belangrijke eigenschap van een stof, omdat deze helpt bij het bepalen van de hoeveelheid stof die in een bepaald monster aanwezig is.
Kookpunt van 1-butanol
C4H9OH heeft een kookpunt van 117,7°C (243,9°F). Dit betekent dat het bij deze temperatuur van vloeistof naar gas zal overgaan. Het kookpunt van C4H9OH is hoger dan dat van ethanol vanwege de aanwezigheid van een extra koolstofatoom.
Smeltpunt van 1-butanol
Het smeltpunt van C4H9OH is -90,6°C (-131,1°F). Dit betekent dat het bij deze temperatuur van vast naar vloeibaar zal veranderen. Het smeltpunt van C4H9OH is lager dan dat van butaanzuur, dat een vergelijkbaar molecuulgewicht heeft.
1-Butanol Dichtheid g/ml
De dichtheid van C4H9OH is 0,81 g/ml. Dit betekent dat één milliliter C4H9OH 0,81 gram weegt. De dichtheid van C4H9OH is lager dan die van water, dat een dichtheid heeft van 1 g/ml.
Molecuulgewicht 1-butanol
Het molecuulgewicht van C4H9OH is 74,12 g/mol. Het is de som van de atoomgewichten van alle atomen in de molecuulformule. Het molecuulgewicht is een belangrijke eigenschap van een stof, omdat het de fysische en chemische eigenschappen ervan helpt bepalen.
Structuur van 1-butanol
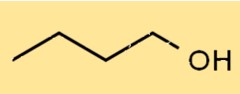
De structuur van C4H9OH is een alcohol met een rechte keten, waarbij de hydroxylgroep (-OH) aan het eerste koolstofatoom is bevestigd. Het heeft een lineaire structuur, met vier koolstofatomen, tien waterstofatomen en één zuurstofatoom. Door zijn structuur kan het waterstofbruggen vormen met andere moleculen.
Oplosbaarheid van 1-butanol
C4H9OH is oplosbaar in water en organische oplosmiddelen. De oplosbaarheid in water neemt af naarmate de temperatuur stijgt. Het is ook oplosbaar in polaire oplosmiddelen, zoals ethanol en methanol. De oplosbaarheid van C4H9OH in organische oplosmiddelen, zoals benzeen en ether, is hoger dan in water. Dit maakt het bruikbaar als oplosmiddel bij organische synthese.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 0,810 g/ml bij 25°C |
| Kleur | Kleurloos |
| Geur | Een beetje zoet |
| Molaire massa | 74,12 g/mol |
| Dikte | 0,81 g/ml |
| Fusie punt | -90,6°C (-131,1°F) |
| Kookpunt | 117,7°C (243,9°F) |
| Flitspunt | 35°C (95°F) |
| oplosbaarheid in water | 79 g/l bij 20°C |
| Oplosbaarheid | Oplosbaar in ethanol, diethylether, aceton, benzeen, chloroform |
| Dampdruk | 1,16 kPa bij 20°C |
| Dampdichtheid | 2,55 (ten opzichte van lucht) |
| pKa | 16.06 |
| pH | Neutraal (7) |
1-Veiligheid en gevaren van butanol
C4H9OH brengt verschillende veiligheidsrisico’s met zich mee, waardoor het van cruciaal belang is om er zorgvuldig mee om te gaan. Het is een brandbare vloeistof die gemakkelijk kan ontbranden bij blootstelling aan hitte of vonken. Het stoot ook schadelijke dampen uit die irritatie en schade aan de ogen, het ademhalingssysteem en de huid kunnen veroorzaken. Wanneer het wordt ingenomen, kan het ernstige gezondheidsproblemen veroorzaken, waaronder duizeligheid, verwarring en zelfs coma. Het is daarom essentieel om beschermende uitrusting te dragen, zoals handschoenen, een veiligheidsbril en een ademhalingstoestel, wanneer u met C4H9OH werkt. Bij contact met de huid of ogen, afspoelen met water en onmiddellijk een arts raadplegen. Een juiste opslag, hantering en verwijdering van C4H9OH zijn noodzakelijk om ongelukken te voorkomen en de veiligheid te garanderen.
| Gevarensymbolen | F, Xi |
| Beveiligingsbeschrijving | Verwijderd houden van hitte/vonken/open vuur/hete oppervlakken. Draag beschermende handschoenen/oogbescherming/gelaatsbescherming. BIJ CONTACT MET DE HUID (of het haar): Verwijder onmiddellijk alle verontreinigde kleding. Huid afspoelen met water/douchen. BIJ CONTACT MET DE OGEN: voorzichtig afspoelen met water gedurende enkele minuten. Verwijder contactlenzen, indien aanwezig en gemakkelijk te doen. Ga door met spoelen. Opslaan in een koele, droge, goed geventileerde ruimte, uit de buurt van onverenigbare stoffen. |
| VN-identificatienummers | VN 1120 |
| HS-code | 2905.16.00 |
| Gevarenklasse | 3 |
| Verpakkingsgroep | III |
| Toxiciteit | LD50 (oraal, rat) 2,46 g/kg; LC50 (inhalatie, rat) 37.800 ppm/4u |
Methoden voor de synthese van 1-butanol
C4H9OH kan op verschillende manieren worden gesynthetiseerd, waaronder butyraldehyde-reductie, oxo-verwerking of fermentatie.
Fermentatie is een gebruikelijke methode om C4H9OH uit biomassa te produceren. Tijdens het fermentatieproces zijn micro-organismen zoals Clostridium acetobutylicum verantwoordelijk voor de productie van een mengsel van organische zuren en alcoholen, waaronder C4H9OH, door suikers, zetmeel of cellulose te fermenteren.
Het oxoproces, ook bekend als hydroformylering, omvat de reactie van propeen met koolmonoxide en waterstof in aanwezigheid van een katalysator zoals kobalt of rhodium. De hydrogenering van butyraldehyde produceert C4H9OH. Wanneer butyraldehyde hydrogenering ondergaat, vormt het de verbinding C4H9OH.
Een andere methode voor het synthetiseren van C4H9OH omvat het reduceren van butyraldehyde met waterstof in aanwezigheid van een katalysator zoals palladium of nikkel. Deze reactie produceert C4H9OH met water als bijproduct.
Het Fischer-Tropsch-proces is een methode om C4H9OH uit fossiele brandstoffen te produceren. Hierbij wordt een katalysator gebruikt om koolmonoxide en waterstof te laten reageren, wat resulteert in de productie van verschillende koolwaterstoffen, waaronder C4H9OH.
Gebruik van 1-butanol
C4H9OH heeft vanwege zijn unieke eigenschappen vele toepassingen in verschillende industrieën. Enkele veel voorkomende toepassingen van C4H9OH zijn onder meer:
- Oplosmiddel: Wordt gebruikt als oplosmiddel voor diverse stoffen, waaronder harsen, vetten, oliën en wassen.
- Tussenproduct: Gebruikt als tussenproduct bij de productie van andere chemicaliën, zoals butylacrylaat en butylacetaat.
- Additief: Wordt gebruikt als additief in benzine- en dieselbrandstoffen om het octaangetal ervan te verhogen en de uitstoot te verminderen.
- Extractiemiddel: Gebruikt als extractiemiddel bij de productie van antibiotica, vitamines en hormonen.
- Cosmetische en persoonlijke verzorgingsproducten: gebruikt bij de productie van verschillende cosmetische en persoonlijke verzorgingsproducten, waaronder lotions, crèmes en parfums.
- Smaken en geuren: Gebruikt als smaak- en geurversterker in de voedingsmiddelen- en drankenindustrie.
- Farmaceutische producten: Gebruikt bij de productie van verschillende farmaceutische producten, waaronder sedativa en hypnotica.
- Pesticiden: Gebruikt als onderdeel bij de productie van verschillende pesticiden en herbiciden.
Vragen:
Vraag: Is butanol polair?
A: Ja, butanol is polair vanwege de aanwezigheid van de hydroxylgroep (-OH), waardoor het een dipoolmoment krijgt.
Vraag: Is 1-butanol oplosbaar in water?
A: Ja, C4H9OH is gedeeltelijk oplosbaar in water vanwege de aanwezigheid van de hydroxylgroep waardoor het waterstofbruggen kan vormen met watermoleculen.
Vraag: Heeft 1-butanol een waterstofbrug?
A: Ja, C4H9OH heeft een waterstofbinding vanwege de aanwezigheid van de hydroxylgroep (-OH) die waterstofbruggen kan vormen met andere C4H9OH-moleculen of met watermoleculen.
Vraag: Hoeveel ml 1-butanol is nodig om 725 ml van een 0,350 ml waterige oplossing van deze opgeloste stof te bereiden?
A: Voor de berekening is de molaire massa van C4H9OH vereist, namelijk 74,12 g/mol. Om een 0,350 M oplossing van C4H9OH te bereiden, is 26,12 g C4H9OH nodig. Met behulp van de formule: mol = concentratie x volume, kunnen we het benodigde volume C4H9OH als volgt berekenen: volume = mol / concentratie. Het volume C4H9OH dat nodig is om 725 ml van een 0,350 m oplossing te bereiden is dus (26,12/0,350) = 74,6 ml.
Vraag: Welke alcohol gedraagt zich het meest als water? c2h5oh c4h9oh c10h21oh c7h15oh
A: Van de gegeven opties zal ethanol (C2H5OH) zich het meest als water gedragen vanwege de kleine moleculaire omvang en de aanwezigheid van de hydroxylgroep (-OH), waardoor het sterke waterstofbruggen met watermoleculen kan vormen.
Vraag: Wat zijn de producten van de gebalanceerde vergelijking voor de verbranding van c4h9oh?
A: De uitgebalanceerde vergelijking voor de verbranding van C4H9OH is: C4H9OH + 6O2 → 4CO2 + 5H2O. De reactieproducten zijn kooldioxide (CO2) en water (H2O).
Vraag: Wat is de molaire massa van butanol (c4h9oh)?
A: De molaire massa van butanol (C4H9OH) is 74,12 g/mol.
Vraag: Heeft C4h9oh een waterstofbrug?
A: Ja, C4H9OH heeft een waterstofbinding vanwege de aanwezigheid van de hydroxylgroep (-OH), waardoor het waterstofbruggen kan vormen met andere C4H9OH-moleculen of met watermoleculen.
Vraag: Hoeveel gram butylalcohol (c4h9oh) zit er in een oplossing van 2500 ml, of 2,22 m?
A: Om het aantal gram butylalcohol in de oplossing te berekenen, moeten we de formule gebruiken: mol = concentratie x volume. De concentratie van de oplossing is 2,22 mol/l en het volume is 2,5 l (2500 ml omgezet in l). Het aantal mol butylalcohol in de oplossing is dus: 2,22 x 2,5 = 5,55 mol. Om de massa van butylalcohol te berekenen, vermenigvuldigt u het aantal mol met de molaire massa (74,12 g/mol): 5,55 x 74,12 = 411,4 g. Er zit dus 411,4 gram butylalcohol in een oplossing van 2500 ml, oftewel 2,22 M.
