Kaliumperchloraat (KClO4) is een verbinding die kalium, chloor en zuurstof bevat. Het wordt vaak gebruikt in pyrotechniek en explosieven vanwege zijn oxiderende eigenschappen.
| Naam van IUPAC | Kaliumperchloraat |
| Moleculaire formule | KClO4 |
| CAS-nummer | 7778-74-7 |
| Synoniemen | Percal K, Kaliumperchloraat, Kaliumchloraat (VII), UN 1489 |
| InChi | InChI=1S/ClHO4.K/c2-1(3,4)5;/h(H,2,3,4,5);/q;+1/p-1 |
Eigenschappen van kaliumperchloraat
Kaliumperchloraatformule
Kaliumperchloraat heeft de chemische formule KClO4, wat aangeeft dat het één kaliumatoom, één chlooratoom en vier zuurstofatomen bevat. De verbinding is een anorganisch zout dat zeer oplosbaar is in water, waardoor het in veel toepassingen een nuttig oxidatiemiddel is.
Kaliumperchloraat Molaire massa
De molaire massa van KClO4 wordt berekend door de atoommassa’s van de samenstellende elementen van de verbinding op te tellen. De atoommassa’s van kalium, chloor en zuurstof zijn respectievelijk 39,10 g/mol, 35,45 g/mol en 16,00 g/mol. De molaire massa van KClO4 is dus 138,55 g/mol.
Kookpunt van kaliumperchloraat
KClO4 heeft geen gedefinieerd kookpunt, omdat het ontleedt voordat het een kookpunt bereikt. Bij verhitting tot hoge temperaturen valt KClO4 uiteen in kaliumchloride en zuurstofgas. Er is echter waargenomen dat de verbinding kan sublimeren bij temperaturen rond de 400 tot 500 ° C.
Kaliumperchloraat Smeltpunt
Het smeltpunt van KClO4 is ongeveer 610°C. Bij deze temperatuur verandert de vaste verbinding in de vloeibare toestand. Het hoge smeltpunt van KClO4 maakt het geschikt voor gebruik in diverse industriële toepassingen.
Dichtheid van kaliumperchloraat g/ml
De dichtheid van KClO4 bedraagt ongeveer 2,52 g/cm³ bij kamertemperatuur. Dit geeft aan dat de verbinding dichter is dan water, dat een dichtheid heeft van 1 g/cm³. De hoge dichtheid van KClO4 maakt het een effectief oxidatiemiddel in pyrotechniek.
Kaliumperchloraat Molecuulgewicht
Het molecuulgewicht van KClO4 is 138,55 g/mol. Deze waarde wordt bepaald door de atoommassa’s van de samenstellende elementen van de verbinding op te tellen. Het molecuulgewicht van KClO4 is nuttig bij het bepalen van de massa van de verbinding die nodig is voor een bepaalde reactie of proces.
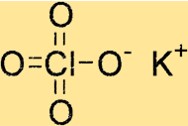
Structuur van kaliumperchloraat
KClO4 heeft een tetragonale kristalstructuur, wat betekent dat het viervoudige symmetrie rond zijn c-as heeft. Het kristalrooster van de verbinding bestaat uit kaliumionen, chloorionen en zuurstofionen, die bij elkaar worden gehouden door ionische bindingen.
Oplosbaarheid van kaliumperchloraat
KClO4 is zeer oplosbaar in water, met een oplosbaarheid van ongeveer 4,5 g/ml bij kamertemperatuur. De verbinding is ook oplosbaar in andere polaire oplosmiddelen zoals ethanol en aceton. Het is echter onoplosbaar in niet-polaire oplosmiddelen zoals benzeen en chloroform. De oplosbaarheid van KClO4 is een belangrijke factor bij het gebruik ervan als oxidatiemiddel in diverse industriële toepassingen.
| Verschijning | Witte kristallijne vaste stof |
| Specifieke dichtheid | 2.52 |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 138,55 g/mol |
| Dikte | 2,52 g/cm³ |
| Fusie punt | 610°C |
| Kookpunt | Ontleedt vóór het kookpunt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 4,5 g/ml bij 25°C |
| Oplosbaarheid | Oplosbaar in ethanol en aceton, onoplosbaar in benzeen en chloroform |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Neutrale |
Veiligheid en gevaren van kaliumperchloraat
KClO4 kan veiligheidsrisico’s met zich meebrengen als het niet op de juiste manier wordt behandeld. De verbinding is een sterk oxidatiemiddel en kan reageren met brandbare materialen en brand of explosies veroorzaken. Inademing van KClO4-stof of -damp kan ook irritatie van de luchtwegen veroorzaken. Langdurige blootstelling aan de verbinding kan huidirritatie of dermatitis veroorzaken. Bij het hanteren van KClO4 is het belangrijk om geschikte persoonlijke beschermingsmiddelen te gebruiken, zoals handschoenen, een veiligheidsbril en een gasmasker. De verbinding moet ook worden bewaard op een koele, droge plaats, uit de buurt van onverenigbare materialen en hitte- en ontstekingsbronnen.
| Gevarensymbolen | Oxidatiemiddel |
| Beveiligingsbeschrijving | Verwijderd houden van brandbare materialen. Draag geschikte persoonlijke beschermingsmiddelen. Vermijd inademen van stof of dampen. |
| VN-identificatienummers | VN1489 |
| HS-code | 2829.90.90 |
| Gevarenklasse | 5.1 – Oxiderende stoffen |
| Verpakkingsgroep | II |
| Toxiciteit | Kan huidirritatie of dermatitis veroorzaken bij langdurige blootstelling. Inslikken of inademen van de verbinding kan irritatie van de luchtwegen veroorzaken. |
Methoden voor de synthese van kaliumperchloraat
KClO4 kan op verschillende manieren worden gesynthetiseerd.
Een gebruikelijke methode is om kaliumchloraat te laten reageren met bariumperchloraat. De reactie produceert KClO4 en bariumchloride als bijproduct, dat kan worden gefilterd.
Een andere methode omvat de reactie van kaliumchloraat met zoutzuur en natriumchloride. Bij de reactie ontstaan KClO4 en natriumchloraat, die door kristallisatie kunnen worden gescheiden.
De reactie tussen kaliumhydroxide en ammoniumperchloraat kan ook KClO4 synthetiseren. Bij de reactie ontstaan KClO4 en ammoniumhydroxide, die door filtratie kunnen worden gescheiden.
Een andere methode omvat de reactie van kaliumchloride met natriumperchloraat in aanwezigheid van een katalysator. Bij de reactie ontstaan KClO4 en natriumchloride, die door kristallisatie kunnen worden gescheiden.
Gebruik van kaliumperchloraat
KClO4 heeft verschillende toepassingen in verschillende industrieën. Enkele veel voorkomende toepassingen zijn:
- Pyrotechniek: Een populair oxidatiemiddel in de pyrotechnische industrie. Gebruikt bij de vervaardiging van vuurwerk, fakkels en andere soorten explosieven.
- Raketpropellers: gebruikt als oxidatiemiddel bij de vervaardiging van raketdrijfgassen. Vaak gebruikt in solide raketboosters en lanceringen van space shuttles.
- Airbag-initiatoren: Gebruikt als initiator bij de vervaardiging van airbags. Om een airbag op te blazen, wordt er een elektrische lading door een met KClO4 gecoate draad gestuurd. Dit veroorzaakt een reactie waarbij stikstofgas ontstaat, waardoor de airbag wordt opgeblazen.
- Lucifers: Gebruikt bij de productie van veiligheidslucifers. Om een brandbare verbinding te produceren die ontbrandt wanneer deze op een ruw oppervlak terechtkomt, wordt deze gemengd met antimoonsulfide en zwavel.
- Galvaniseren: Gebruikt in de galvaniseerindustrie als onderdeel van elektrolyten die worden gebruikt voor het galvaniseren van metalen.
- Geneeskunde: Gebruikt bij de behandeling van schildklieraandoeningen zoals hyperthyreoïdie. Het gebruik ervan in de geneeskunde is echter afgenomen vanwege bezorgdheid over de veiligheid.
- Analytische chemie: Wordt ook gebruikt als reagens in de analytische chemie voor de bepaling van bepaalde stoffen.
Vragen:
Vraag: Welke soorten bindingen zitten er in een molecuul kaliumperchloraat?
A: KClO4 bevat zowel ionische als covalente bindingen. Het K+-ion en het ClO4–ion worden bij elkaar gehouden door ionische bindingen, terwijl het perchloraation zelf zowel covalente als ionische bindingen bevat.
Vraag: Wat is de formule voor kaliumperchloraat?
A: KClO4.
Vraag: Is kaliumperchloraat waterig?
A: KClO4 kan in water oplossen, waardoor het onder bepaalde omstandigheden waterig wordt.
Vraag: Waar wordt kaliumperchloraat voor gebruikt?
A: KClO4 heeft verschillende toepassingen, onder meer in vuurwerk, raketaanjagers en airbag-opblaasapparaten. Het wordt ook gebruikt in de analytische chemie als reagens en oxidatiemiddel.
Vraag: Hoe maak ik flitspoeder zonder kaliumperchloraat?
A: Flitspoeder kan worden gemaakt zonder KClO4 met behulp van alternatieve oxidatiemiddelen, zoals ammoniumperchloraat, natriumperchloraat of bariumperoxide.
Vraag: Wat is de oxidatietoestand van een individueel chlooratoom in KClO4?
A: De oxidatietoestand van het individuele chlooratoom in KClO4 is +7.
Vraag: Is KClO4 oplosbaar in water?
A: Ja, KClO4 is oplosbaar in water.
Vraag: Is KClO4 een zuur of een base?
A: KClO4 is noch een zuur, noch een base. Het is een zout dat bestaat uit een metaal (kalium) en een polyatomisch ion (perchloraat).
