Calciumbisulfiet (Ca(HSO3)2) is een verbinding bestaande uit calcium, zwavel en zuurstof. Het wordt vaak gebruikt als conserveermiddel en antioxidant in de voedingsindustrie.
| IUPAC-naam | Calciumwaterstofsulfiet |
| Moleculaire formule | Ca(HSO3)2 |
| CAS-nummer | 13780-03-5 |
| Synoniemen | Calciumbisulfiet, Calciumwaterstofsulfiet, Calciumzwavelzuur, Kalkbisulfiet |
| InChi | InChI=1S/Ca.2H2O3S/c;2*1-4(2)3/h;(H2,1,2,3)/q+2;;/p-2 |
Eigenschappen van calciumbisulfiet
Calciumbisulfietformule
De chemische formule voor calciumbisulfiet is Ca(HSO3)2. Het geeft het aantal en het type atomen in een molecuul of formule-eenheid aan. De formule is belangrijk bij het bepalen van het molecuulgewicht, de molmassa en andere eigenschappen van de verbinding. Ca(HSO3)2 is een belangrijke verbinding die in de voedingsindustrie wordt gebruikt als conserveermiddel en antioxidant.
Molaire massa van calciumbisulfiet
Ca(HSO3)2 heeft een molaire massa van 202,2 g/mol. Het is een ionische verbinding bestaande uit calcium, waterstofsulfiet en zwaveldioxide. De molaire massa is belangrijk voor het berekenen van de hoeveelheid Ca(HSO3)2 die nodig is bij een reactie of voor het bereiden van een oplossing met de gewenste concentratie.
Kookpunt van calciumbisulfiet
Het kookpunt van Ca(HSO3)2 is geen goed gedefinieerde waarde, omdat het ontleedt voordat het zijn kookpunt bereikt. Ca(HSO3)2 ontleedt, waarbij zwaveldioxide vrijkomt. Daarom wordt het niet gebruikt in processen die toepassingen bij hoge temperaturen vereisen.
Calciumbisulfiet Smeltpunt
Het smeltpunt van Ca(HSO3)2 bedraagt 203°C. Bij deze temperatuur ontleedt het onder vorming van calciumsulfaat en zwaveldioxide. De ontleding van Ca(HSO3)2 is een exotherme reactie en produceert een grote hoeveelheid warmte. Daarom moet er bij verhitting voorzichtig mee worden omgegaan.
Dichtheid van calciumbisulfiet g/ml
De dichtheid van Ca(HSO3)2 varieert afhankelijk van de vorm waarin het wordt aangetroffen. De watervrije vorm van Ca(HSO3)2 heeft een dichtheid van 2,68 g/ml, terwijl de dihydraatvorm een dichtheid heeft van 1,98 g/ml. De dichtheid van een stof is belangrijk bij het bepalen hoeveel van de stof nodig is om een bepaald volume te vullen.
Calciumbisulfiet Molecuulgewicht
Het molecuulgewicht van Ca(HSO3)2 bedraagt 202,2 g/mol. Het wordt berekend door de atoomgewichten van de samenstellende elementen op te tellen: calcium (40,08 g/mol), waterstof (1,008 g/mol), zwavel (32,06 g/mol) en zuurstof (15,99 g/mol). Het molecuulgewicht is belangrijk bij het bepalen van de hoeveelheid stof die nodig is voor een reactie.
Structuur van calciumbisulfiet
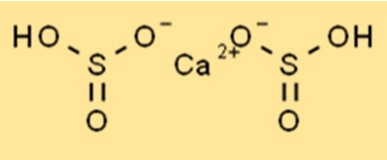
De structuur van Ca(HSO3)2 is een ionische verbinding met de chemische formule Ca(HSO3)2. Het heeft een tetraëdrische vorm met een centraal calciumatoom omgeven door vier zuurstofatomen. Waterstofsulfietionen zijn via ionische bindingen aan het calciumatoom gekoppeld. De structuur van Ca(HSO3)2 is belangrijk voor het begrijpen van de chemische eigenschappen ervan.
Oplosbaarheid van calciumbisulfiet
Ca(HSO3)2 is matig oplosbaar in water, met een oplosbaarheid van ongeveer 60 gram per 100 milliliter water bij kamertemperatuur. De oplosbaarheid neemt toe met de temperatuur en het is ook oplosbaar in ethanol en glycerol.
| Verschijning | Wit kristallijn poeder |
| Soortelijk gewicht | 2,68 (watervrij), 1,98 (dihydraat) |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 202,2 g/mol |
| Dikte | 2,68 g/ml (watervrij), 1,98 g/ml (dihydraat) |
| Fusie punt | 203°C |
| Kookpunt | Ontbonden |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Oplosbaar |
| Oplosbaarheid | Oplosbaar in water, onoplosbaar in organische oplosmiddelen |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 1,92 |
| pH | 4,5-6,0 |
Veiligheid en gevaren van calciumbisulfiet
Ca(HSO3)2 wordt over het algemeen als veilig beschouwd als het in kleine hoeveelheden in voedingsmiddelen wordt gebruikt. Het kan echter gevaarlijk zijn als het niet op de juiste manier wordt behandeld. Bij inademing kan het huidirritatie, oogirritatie en ademhalingsproblemen veroorzaken. Inslikken van grote hoeveelheden kan maag-darmklachten veroorzaken, waaronder misselijkheid en braken. Er moet met voorzichtigheid worden omgegaan met Ca(HSO3)2 en bij het werken met Ca(HSO3)2 moeten beschermende uitrusting, zoals handschoenen en een gasmasker, worden gedragen. Het moet op een koele, droge plaats worden bewaard, uit de buurt van hitte en onverenigbare materialen. Gemorste vloeistoffen moeten onmiddellijk worden opgeruimd om blootstelling aan de stof te voorkomen.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Vermijd inademing, inslikken en huid-/oogcontact. Draag beschermende uitrusting. |
| VN-identificatienummers | Niet gereguleerd |
| HS-code | 28321000 |
| Gevarenklasse | Niet geclassificeerd |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Lage toxiciteit, maar kan huid- en oogirritatie, ademhalingsproblemen en maag-darmklachten veroorzaken als het in grote hoeveelheden wordt ingenomen. |
Methoden voor de synthese van calciumbisulfiet
Er kunnen verschillende methoden worden gebruikt om Ca(HSO3)2 te synthetiseren.
Eén methode omvat het laten reageren van zwaveldioxidegas met calciumhydroxide , waarbij Ca(HSO3)2 en water worden geproduceerd.
Het proces omvat het laten reageren van calciumoxide met zwaveldioxidegas, waardoor calciumsulfiet ontstaat. Vervolgens produceert de reactie van zwaveldioxidegas met calciumsulfiet Ca(HSO3)2.
De reactie van zwaveldioxidegas met water en calciumcarbonaat produceert Ca(HSO3)2, kooldioxidegas en water.
Om Ca(HSO3)2 in het laboratorium te synthetiseren, kan men zwaveldioxidegas toevoegen aan een oplossing van calciumhydroxide of calciumoxide totdat de gewenste pH is bereikt. De resulterende oplossing zal Ca(HSO3)2 bevatten, dat kan worden gezuiverd door filtratie- of precipitatiemethoden.
Gebruik van calciumbisulfiet
Ca(HSO3)2 heeft vanwege zijn unieke eigenschappen verschillende toepassingen in verschillende industrieën. Hier zijn enkele van de meest voorkomende toepassingen van Ca(HSO3)2:
- Voedingsindustrie: Gebruikt als voedselconserveermiddel om de groei van bacteriën en andere micro-organismen in voedingsproducten te voorkomen, vooral in fruit en groenten.
- Waterbehandeling: Gebruikt bij waterbehandeling om overtollig chloor en andere chemicaliën uit water te verwijderen en om de groei van bacteriën en algen in watersystemen te voorkomen.
- Textielindustrie: Gebruikt in de textielindustrie om overtollige kleurstof uit stof te verwijderen en vervaging tijdens het verfproces te voorkomen.
- Papierindustrie: Gebruikt in de papierindustrie om pulp witter te maken en verkleuring van papierproducten te voorkomen.
- Chemische industrie: Gebruikt in de chemische industrie als reductiemiddel en als bron van zwaveldioxidegas.
- Farmaceutische industrie: Gebruikt in de farmaceutische industrie als antioxidant en conserveermiddel in bepaalde medicijnen.
Vragen:
Vraag: Keurt de Europese Autoriteit voor voedselveiligheid calciumbisulfiet goed?
A: Ja, de Europese Autoriteit voor voedselveiligheid (EFSA) heeft het gebruik van Ca(HSO3)2 als levensmiddelenadditief goedgekeurd. Het staat vermeld als een goedgekeurd voedselconserveermiddel in de Europese Unie.
Vraag: Wat is de E-waarde van calciumbisulfiet?
A: Het E-nummer van Ca(HSO3)2 is E227. Het E-nummer is een code die door de Europese Unie aan levensmiddelenadditieven wordt toegekend.
Vraag: Is calciumbisulfiet veilig?
A: Ca(HSO3)2 wordt over het algemeen als veilig beschouwd voor consumptie in kleine hoeveelheden. Het kan echter huid- en oogirritatie, ademhalingsproblemen en maag-darmklachten veroorzaken als het in grote hoeveelheden wordt ingenomen. Het is belangrijk om Ca(HSO3)2 op de juiste manier te hanteren en op te slaan om de veiligheid ervan te garanderen.
Vraag: Wat is de oplosbaarheid van calciumbisulfiet in water?
A: Ca(HSO3)2 is matig oplosbaar in water, met een oplosbaarheid van ongeveer 60 gram per 100 milliliter water bij kamertemperatuur.
Vraag: Wat zijn de thermodynamische eigenschappen van calciumbisulfiet?
A: De thermodynamische eigenschappen van Ca(HSO3)2 omvatten een smeltpunt van ongeveer 150°C en een kookpunt van ongeveer 160°C. De warmtecapaciteit en vormingsenthalpie zijn ook onderzocht in verschillende onderzoeken.
