Calciumsulfiet (CaSO3) is een verbinding die Ca2+- en SO32–ionen bevat. Het wordt vaak gebruikt als voedselconserveermiddel, antioxidant en waterzuiveraar vanwege het vermogen om onzuiverheden te verwijderen en bederf te voorkomen.
| IUPAC-naam | Calciumsulfiet |
| Moleculaire formule | CaSO3 |
| CAS-nummer | 10257-55-3 |
| Synoniemen | Calciumsulfiet; Zwavelzuur, calciumzout; Calciumzwavelzuur; Calciumzwavelzuur; E226 |
| InChi | InChI=1S/Ca.H2O3S/c;1-4(2)3/h;(H2,1,2,3)/q+2;/p-2 |
Eigenschappen van calciumsulfiet
Calciumsulfietformule
De chemische formule voor calciumsulfiet is CaSO3. Deze verbinding bestaat uit een Ca2+-ion en een SO32–ion. Calciumsulfiet kan worden bereid door calciumhydroxide te laten reageren met zwavelzuur. Het wordt vaak gebruikt in de voedingsindustrie als conserveermiddel en antioxidant, maar ook als waterzuiveraar.
Calciumsulfiet Molaire massa
De molaire massa van CaSO3 is 120,14 g/mol. Dit kan worden berekend door de atoommassa’s van calcium (40,08 g/mol), zwavel (32,06 g/mol) en drie zuurstofatomen (elk 16,00 g/mol) op te tellen.
Kookpunt van calciumsulfiet
CaSO3 heeft geen duidelijk kookpunt, omdat het ontleedt voordat het zijn kookpunt bereikt. Het kan echter worden verwarmd tot een temperatuur van ongeveer 450°C voordat ontbinding optreedt. Dit komt omdat CaSO3 een onstabiele verbinding is en bij verhitting de neiging heeft te ontbinden in calciumsulfaat en zwaveldioxide.
Smeltpunt van calciumsulfiet
Het smeltpunt van CaSO3 is ongeveer 1520°C. Dit is de temperatuur waarbij de vaste verbinding overgaat in de vloeibare toestand. CaSO3 heeft een kristallijne structuur en smelt bij hoge temperaturen vanwege de sterke ionische bindingen tussen calcium- en sulfietionen.
Dichtheid van calciumsulfiet g/ml
De dichtheid van CaSO3 bedraagt ongeveer 2,71 g/ml. Dit betekent dat één milliliter CaSO3 een massa heeft van 2,71 gram. De hoge dichtheid van CaSO3 is te danken aan de aanwezigheid van het calciumion, dat een hoge atoommassa heeft.
Calciumsulfiet Molecuulgewicht
Het molecuulgewicht van CaSO3 is 120,14 g/mol. Dit kan worden berekend door de atoomgewichten van calcium-, zwavel- en drie zuurstofatomen in de verbinding op te tellen. Het molecuulgewicht van CaSO3 is belangrijk bij het bepalen van de fysische en chemische eigenschappen ervan.
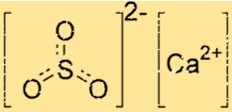
Structuur van calciumsulfiet
De structuur van CaSO3 bestaat uit één Ca2+-ion en één SO32-ion. Het calciumion is omgeven door zes zuurstofatomen, terwijl het sulfietion twee zuurstofatomen en één zwavelatoom heeft. Het Ca2+-ion en het SO32-ion worden bij elkaar gehouden door ionische bindingen, dit zijn sterke elektrostatische aantrekkingskrachten tussen tegengesteld geladen ionen.
Oplosbaarheid van calciumsulfiet
CaSO3 is slecht oplosbaar in water, met een oplosbaarheid van ongeveer 0,17 g/100 ml bij kamertemperatuur. Dit betekent dat slechts een kleine hoeveelheid CaSO3 in water kan oplossen en dat de overige vaste deeltjes in het water blijven zweven. De oplosbaarheid van CaSO3 wordt beïnvloed door factoren zoals temperatuur, pH en de aanwezigheid van andere ionen.
| Verschijning | Wit poeder of kristallijne vaste stof |
| Soortelijk gewicht | 2.71 |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 120,14 g/mol |
| Dikte | 2,71 g/ml |
| Fusie punt | 1520°C |
| Kookpunt | Ontleedt voordat het kookpunt wordt bereikt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Enigszins oplosbaar, ca. 0,17 g/100 ml bij kamertemperatuur. |
| Oplosbaarheid | Onoplosbaar in alcohol en ether |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 1,91 |
| pH | Enigszins basisch (pH 8-9 indien opgelost in water) |
Veiligheid en gevaren van calciumsulfiet
CaSO3 wordt over het algemeen als veilig beschouwd voor gebruik in voedsel- en waterbehandelingstoepassingen. Zoals elke chemische stof kan het echter bepaalde gevaren met zich meebrengen als het niet op de juiste manier wordt behandeld. CaSO3 is irriterend voor huid en ogen en kan bij inademing irritatie van de luchtwegen veroorzaken. Het innemen van grote hoeveelheden CaSO3 kan misselijkheid, braken en diarree veroorzaken. Bij het hanteren van CaSO3 moeten passende veiligheidsmaatregelen worden genomen, zoals het dragen van handschoenen en een veiligheidsbril. Men moet onmiddellijk medische hulp inroepen als men in contact komt met CaSO3 op de huid of ogen, of als men het inslikt. Het is ook belangrijk om de juiste CaSO3-opslag- en verwijderingsprocedures te volgen om potentiële gevaren te minimaliseren.
| Gevarensymbolen | Geen toegewezen |
| Beveiligingsbeschrijving | Vermijd contact met ogen, huid en kleding. Draag bij het hanteren beschermende handschoenen en een bril. In geval van contact de getroffen gebieden met water afspoelen. Bij inslikken onmiddellijk medische hulp inroepen. |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | 283210 |
| Gevarenklasse | Niet geclassificeerd als gevaarlijk |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Calciumsulfiet wordt bij lage concentraties als niet-toxisch beschouwd, maar kan bij hoge doses gastro-intestinale irritatie en andere gezondheidseffecten veroorzaken. |
Synthesemethoden voor calciumsulfiet
De reactie van zwavelig zuur met calciumhydroxide kan CaSO3 synthetiseren. Bij de reactie ontstaan CaSO3 en water als bijproducten.
Een andere methode is het laten reageren van calciumcarbonaat met zwavelzuur, waarbij CaSO3, water en kooldioxide ontstaat. Normaal gesproken voeren chemici de reactie uit in een waterige oplossing bij kamertemperatuur of iets hoger.
Bij een andere methode produceert het laten reageren van calciumoxide met zwaveldioxide en het vervolgens toevoegen van water aan het resulterende product CaSO3.
In industriële omgevingen produceert de absorptie van zwaveldioxide in een suspensie van calciumhydroxide doorgaans CaSO3. Dit proces produceert een mengsel van CaSO3 en calciumsulfaat, dat kan worden gescheiden door filtratie of andere methoden. Het resulterende CaSO3 kan worden gebruikt in een verscheidenheid aan toepassingen, waaronder waterbehandeling en als voedselconserveermiddel.
Over het algemeen zijn er verschillende methoden voor het synthetiseren van CaSO3, elk met zijn eigen voordelen en beperkingen, afhankelijk van de specifieke toepassing en de gewenste zuiverheid van het eindproduct.
Gebruik van calciumsulfiet
CaSO3 heeft vanwege zijn unieke eigenschappen verschillende toepassingen in verschillende industrieën. Enkele veel voorkomende toepassingen van CaSO3 zijn:
- Waterbehandeling: Vaak gebruikt als waterbehandelingsmiddel om onzuiverheden te verwijderen en water te desinfecteren. Het kan effectief chloor, zware metalen en andere verontreinigingen uit water verwijderen.
- Voedselbehoud: Gebruikt als voedselconserveermiddel om bederf te voorkomen en de houdbaarheid van voedselproducten te verlengen. Vaak gebruikt bij de productie van ingeblikt en gebotteld voedsel, maar ook bij het maken van wijn en bier.
- Chemische industrie: Gebruikt in de chemische industrie als reductiemiddel en bij de productie van zwavelzuur.
- Constructie: Gebruikt als onderdeel van bouwmaterialen zoals gipsplaat en cement.
- Agrarische industrie: Gebruikt in de landbouw om de bodem te behandelen en plantenziekten te voorkomen.
- Medische toepassingen: Wordt ook gebruikt in medische toepassingen als antioxidant en als behandeling voor bepaalde medische aandoeningen.
Vragen:
Vraag: Wat is de formule voor calciumsulfiet?
A: De formule voor calciumsulfiet is CaSO3.
Vraag: Wat is de toestand van calciumsulfiet?
A: CaSO3 is een vaste stof bij kamertemperatuur.
Vraag: Hoeveel gram calcium zit er in 3,36 gram CaSO3?
A: Er is ongeveer 1,14 gram calcium aanwezig in 3,36 gram CaSO3.
Vraag: Wat gebeurt er als je calciumcarbonaat toevoegt aan zoutzuur en natriumsulfiet?
A: Wanneer calciumcarbonaat wordt toegevoegd aan zoutzuur en natriumsulfiet, vindt er een reactie plaats waarbij CaSO3, water, kooldioxide en natriumchloride ontstaan.
Vraag: Lost calciumsulfiet op in water?
A: Ja, CaSO3 is enigszins oplosbaar in water.
Vraag: Zit er calciumsulfiet in stadswater?
A: CaSO3 wordt niet vaak aangetroffen in stadswater, maar kan worden gebruikt in waterzuiveringsprocessen om onzuiverheden te verwijderen.
Vraag: Kan CaSO3 uit drinkwater worden verwijderd?
A: Ja, CaSO3 kan op verschillende manieren uit drinkwater worden verwijderd, zoals filtratie, omgekeerde osmose of chemische behandeling.
Vraag: Wat produceren CaSO3 en HCl?
A: Wanneer CaSO3 aan zoutzuur wordt toegevoegd, vindt er een reactie plaats waarbij calciumchloride, zwaveldioxidegas en water ontstaan.
