Natriumsulfiet, ook bekend als Na2SO3, is een wit kristallijn poeder dat vaak wordt gebruikt als conserveermiddel in de voedingsindustrie en als reductiemiddel in de fotografie.
| IUPAC-naam | Dinatriumsulfiet |
| Moleculaire formule | Na2SO3 |
| CAS-nummer | 7757-83-7 |
| Synoniemen | Natriumsulfiet; Dinatriumsulfiet; Zwavelzuur, dinatriumzout; Natriumsulfonaat; Natriumsulfiet |
| InChi | InChI=1S/2Na.H2O3S/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
Eigenschappen van natriumsulfiet
Natriumsulfietformule
De chemische formule voor natriumsulfiet is Na2SO3. Het bestaat uit twee Na+-ionen en één SO32-ion. Na+-ionen hebben een positieve lading, terwijl het SO32-ion een negatieve lading heeft. Natriumsulfiet is een ionische verbinding die een wit kristallijn poeder vormt.
Natriumsulfiet molaire massa
De molmassa van Na2SO3 bedraagt 126,04 g/mol. Deze waarde wordt verkregen door de atoommassa’s van elk element in de verbinding op te tellen. De atoommassa’s van natrium, zwavel en zuurstof zijn respectievelijk 22,99 g/mol, 32,06 g/mol en 15,99 g/mol. Molaire massa is een belangrijke parameter die wordt gebruikt bij stoichiometrische berekeningen en kan ook worden gebruikt om de hoeveelheid stof in een monster te bepalen.
Kookpunt van natriumsulfiet
Na2SO3 heeft een relatief hoog kookpunt van 1650°C. Dit komt door de sterke ionische bindingen tussen de Na+- en SO32–ionen, die een grote hoeveelheid energie nodig hebben om te breken. Het kookpunt is de temperatuur waarbij een stof overgaat van een vloeibare fase naar een gasfase. Bij deze temperatuur is de dampspanning van de vloeistof gelijk aan de atmosferische druk.
Smeltpunt van natriumsulfiet
Het smeltpunt van Na2SO3 is 33,4°C. Dit relatief lage smeltpunt is te wijten aan zwakke intermoleculaire krachten tussen Na2SO3-moleculen. Bij verhitting worden de intermoleculaire krachten overwonnen en smelt het vaste Na2SO3 tot een vloeistof.
Dichtheid van natriumsulfiet g/ml
De dichtheid van Na2SO3 bedraagt 2,633 g/ml. Dichtheid wordt gedefinieerd als de massa van een stof per volume-eenheid. De hoge dichtheid van Na2SO3 is te danken aan zijn ionische aard en de aanwezigheid van twee natriumionen per sulfietion in zijn structuur.
Natriumsulfiet Molecuulgewicht
Het molecuulgewicht van Na2SO3 bedraagt 126,04 g/mol. Deze waarde wordt verkregen door de atoomgewichten van elk element in de verbinding op te tellen. Het molecuulgewicht is een belangrijke parameter die wordt gebruikt bij stoichiometrische berekeningen en kan ook worden gebruikt om de hoeveelheid stof in een monster te bepalen.
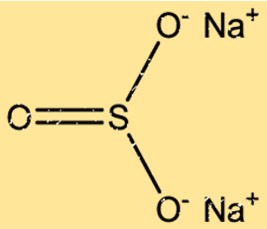
Structuur van natriumsulfiet
Na2SO3 heeft een kristalstructuur met twee Na+-ionen en één SO32-ion, gerangschikt in een zich herhalend patroon. De Na+-ionen zijn gerangschikt in een kubusvormig rooster met het gezicht in het midden, terwijl de SO32-ionen de octaëdrische plaatsen van het rooster bezetten. De ionische bindingen tussen de Na+- en SO32–ionen resulteren in een stabiele kristalstructuur.
Oplosbaarheid van natriumsulfiet
Na2SO3 is zeer oplosbaar in water, met een oplosbaarheid van 22,4 g/100 ml bij 20°C. Deze hoge oplosbaarheid is te danken aan de ionische aard van Na2SO3, waardoor het in water kan dissociëren en Na+- en SO32–ionen kan vormen. De oplosbaarheid van Na2SO3 in water neemt toe met de temperatuur, naarmate de kinetische energie van de moleculen toeneemt en er meer ionen in de oplossing vrijkomen.
| Verschijning | Wit kristallijn poeder |
| Soortelijk gewicht | 2.633 g/cm³ |
| Kleur | Kleurloos tot wit |
| Geur | Geurloos |
| Molaire massa | 126,04 g/mol |
| Dikte | 2.633 g/ml |
| Fusie punt | 33,4°C |
| Kookpunt | 1650°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar |
| Oplosbaarheid | Oplosbaar in glycerol, enigszins oplosbaar in ethanol |
| Dampdruk | 0 mmHg bij 20°C |
| Dampdichtheid | Niet toepasbaar |
| pKa | 06:35 uur |
| pH | 8,3 – 9,5 (5% oplossing) |
Veiligheid en gevaren van natriumsulfiet
Na2SO3 kan gevaarlijk zijn als er niet op de juiste manier mee wordt omgegaan. Het kan huid- en oogirritatie veroorzaken en kan bij inslikken misselijkheid, braken en buikpijn veroorzaken. Bij inademing kan het ook irritatie van de luchtwegen veroorzaken. Bovendien kan Na2SO3 reageren met andere chemicaliën en giftige gassen produceren, zoals zwaveldioxide, die schadelijk kunnen zijn voor uw gezondheid. Het is daarom belangrijk om geschikte persoonlijke beschermingsmiddelen te dragen bij het hanteren van Na2SO3 en om blootstelling aan ogen, huid en slijmvliezen te vermijden. Na2SO3 moet ook worden bewaard in een koele, droge, goed geventileerde ruimte, uit de buurt van onverenigbare materialen.
| Gevarensymbolen | Xi, O |
| Beveiligingsbeschrijving | Vermijd contact met huid en ogen. Bij contact onmiddellijk met veel water afspoelen en een arts raadplegen. Niet inslikken. Vermijd inademing van stof. Draag geschikte persoonlijke beschermingsmiddelen. Uit de buurt houden van hitte, vonken en vlammen. |
| EEN ID | 1384 |
| HS-code | 283210 |
| Gevarenklasse | 8 – Bijtende stoffen |
| Verpakkingsgroep | III |
| Toxiciteit | LD50 (oraal, rat) – 1.640 mg/kg; LC50 (inhalatie, rat) – 63 mg/m³ |
Methoden voor de synthese van natriumsulfiet
Er zijn verschillende methoden om Na2SO3 te synthetiseren.
Een gebruikelijke methode is om natriumhydroxide te laten reageren met zwaveldioxidegas in aanwezigheid van water. Bij de reactie ontstaan Na2SO3 en water als bijproducten.
Bij een andere methode reageert natriumcarbonaat met zwaveldioxidegas in aanwezigheid van water, waarbij Na2SO3 en kooldioxidegas worden geproduceerd. Om de opbrengst aan Na2SO3 te verhogen kan deze reactie bij hoge temperaturen en drukken worden uitgevoerd.
De reactie van natriumbisulfiet met natriumhydroxide kan Na2SO3 synthetiseren. Bij deze reactie ontstaan Na2SO3, water en natriumchloride als bijproducten.
Een andere methode omvat het laten reageren van natriumsulfide met zwaveldioxidegas in aanwezigheid van water om Na2SO3 en waterstofsulfidegas te produceren.
Om Na2SO3 te synthetiseren moet natriumsulfaat worden behandeld met zwaveldioxidegas in aanwezigheid van een reductiemiddel, zoals actieve kool. Bij deze reactie ontstaan Na2SO3 en kooldioxide.
Elk van deze methoden heeft zijn eigen voor- en nadelen, en de keuze van de methode hangt af van verschillende factoren, zoals de gewenste opbrengst, zuiverheid en kosten van het product, en de beschikbaarheid van reagentia en apparatuur.
Gebruik van natriumsulfiet
Na2SO3 heeft verschillende belangrijke industriële en commerciële toepassingen, waaronder:
- Fotografie: Gebruikt als reductiemiddel en conserveermiddel in fotografische ontwikkelingsoplossingen. Dit helpt het beeld te stabiliseren en vervaging te voorkomen.
- Waterbehandeling: Gebruikt om chloor en overtollige zuurstof uit water in industriële en gemeentelijke waterzuiveringsinstallaties te verwijderen. Het helpt ook corrosie van leidingen en apparatuur te voorkomen.
- Papier- en pulpindustrie: gebruikt bij de productie van papier en pulp om het ligninegehalte van de pulp witter te maken en te verminderen. Dit helpt de kwaliteit en kleur van het papier te verbeteren.
- Voedingsindustrie: Gebruikt als conserveermiddel en antioxidant in de voedingsindustrie. Het helpt verkleuring en bederf van voedsel, zoals gedroogd fruit, wijn en bier, te voorkomen.
- Textielindustrie: Gebruikt als reductiemiddel en bleekmiddel in de textielindustrie om overtollige kleurstof te verwijderen en de kleurvastheid van stoffen te verbeteren.
- Chemische industrie: Gebruikt als reductiemiddel bij verschillende chemische reacties, zoals bij de productie van kleurstoffen, farmaceutische producten en polymeren.
- Ander gebruik: Wordt ook gebruikt bij de vervaardiging van wasmiddelen, leerproducten en producten voor persoonlijke verzorging, zoals haarkleurmiddelen en shampoos.
Vragen:
Vraag: Wat is normaal natriumsulfiet in een ketel?
A: De normale concentratie Na2SO3 in een ketel ligt doorgaans tussen 20 en 40 delen per miljoen (ppm), afhankelijk van de bedrijfsdruk en andere factoren.
Vraag: Hoe breng je zwaveldioxide in evenwicht met natriumhydroxide om natriumsulfiet en water te vormen?
A: Om de vergelijking voor de reactie van zwaveldioxide en natriumhydroxide in evenwicht te brengen om Na2SO3 en water te vormen, moet je ervoor zorgen dat er een gelijk aantal atomen van elk element aan de twee kanten van de vergelijking zitten. De uitgebalanceerde vergelijking zou SO2 + 2NaOH → Na2SO3 + H2O zijn.
Vraag: Wat is natriumsulfiet?
A: Na2SO3 is een witte kristallijne verbinding die vaak wordt gebruikt in verschillende industriële en commerciële toepassingen, zoals fotografie, waterbehandeling, papierproductie en voedselconservering.
Vraag: Wat is de formule voor natriumsulfiet?
A: De formule voor natriumsulfiet is Na2SO3.
Vraag: Is natriumsulfiet gebaseerd?
A: Na2SO3 is een zout van een sterke base (natriumhydroxide) en een zwak zuur (zwavelzuur) en heeft daarom basische eigenschappen. Het wordt echter over het algemeen niet als een solide basis beschouwd.
Vraag: Is natriumsulfiet stabiel in water?
A: Na2SO3 is relatief stabiel in water, maar kan na verloop van tijd geleidelijk ontleden, vooral in de aanwezigheid van zuurstof of andere oxidatiemiddelen.
Vraag: Is natriumsulfiet ontvlambaar?
A: Na2SO3 is niet ontvlambaar, maar kan reageren met bepaalde oxidatiemiddelen, waarbij zwaveldioxide vrijkomt, wat irriterend is voor de luchtwegen en ontvlambaar kan zijn.
Vraag: Waar kun je lokaal natriumsulfiet kopen?
A: Na2SO3 kan worden gekocht bij chemische toeleveringsbedrijven, industriële leveranciers en enkele speciaalzaken. Het is mogelijk ook verkrijgbaar bij sommige lokale bouwmarkten of thuisverbeteringscentra.
Vraag: Welke voedingsmiddelen bevatten natriumsulfiet?
A: Na2SO3 wordt vaak gebruikt als conserveermiddel in voedingsmiddelen zoals wijn, bier, gedroogd fruit en sommige soorten vleeswaren.
Vraag: Welk product is gelijk aan natriumsulfiet?
A: Natriumbisulfiet is een soortgelijke verbinding die in sommige toepassingen kan worden gebruikt als vervanging voor Na2SO3. Andere vervangingsmiddelen kunnen natriummetabisulfiet of kaliummetabisulfiet zijn.
