Calciumthiosulfaat (CaO3S2) is een verbinding bestaande uit calcium, zuurstof en zwavel. Het wordt vaak gebruikt in de medische en agrarische industrie als meststof en als behandeling voor bepaalde medische aandoeningen.
| IUPAC-naam | Calciumthiosulfaat |
| Moleculaire formule | CaO3S2 |
| CAS-nummer | 10124-41-1 |
| Synoniemen | Calciumhyposulfiet; Calciumthiosulfaat; Calciumsulfhydraat; Calciumthiosulfonaat |
| InChi | InChI=1S/Ca.H2O3S2/c;1-4(2)3/h;(H2,1,2,3)/q+2;/p-2 |
Eigenschappen van calciumthiosulfaat
Calciumthiosulfaatformule
De chemische formule voor calciumthiosulfaat is CaS2O3. Het geeft het type en het aantal atomen in een molecuul aan. De formule kan worden gebruikt om de molaire massa en andere eigenschappen van de verbinding te bepalen.
Calciumthiosulfaat Molaire massa
De molaire massa van CaO3S2 is 152,18 g/mol. Het bestaat uit één calciumatoom, drie zuurstofatomen en twee zwavelatomen. Molaire massa is een belangrijke eigenschap die wordt gebruikt bij chemische berekeningen, bijvoorbeeld om te bepalen hoeveel van een stof nodig is om een bepaalde reactie te veroorzaken.
Kookpunt van calciumthiosulfaat
CaO3S2 heeft geen duidelijk kookpunt omdat het ontleedt voordat het wordt gekookt. Het begint rond de 75°C te ontbinden en er komt zwaveldioxide vrij. Het kookpunt van een stof is de temperatuur waarbij deze bij een bepaalde druk overgaat van een vloeistof naar een gas.
Calciumthiosulfaat Smeltpunt
Het smeltpunt van CaO3S2 is 155°C. Bij deze temperatuur verandert de vaste verbinding van vast naar vloeibaar. Smeltpunt is een belangrijke eigenschap die wordt gebruikt om stoffen te identificeren en te classificeren.
Dichtheid van calciumthiosulfaat g/ml
De dichtheid van CaO3S2 is 2,67 g/ml. Dichtheid is de hoeveelheid massa per volume-eenheid. De dichtheid van een stof kan worden gebruikt om te bepalen of deze zal drijven of zinken in een andere stof, zoals water.
Calciumthiosulfaat Molecuulgewicht
Het molecuulgewicht van CaO3S2 is 152,18 g/mol. Het is de som van de atoomgewichten van alle atomen in een molecuul. Het molecuulgewicht wordt gebruikt om verschillende eigenschappen van een stof te berekenen, zoals de molariteit of concentratie ervan.
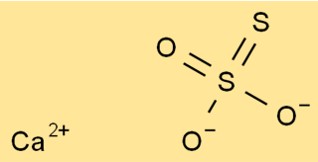
Structuur van calciumthiosulfaat
De structuur van CaO3S2 bestaat uit één Ca2+-ion en één S2O32-ion. Het thiosulfaation heeft een centraal zwavelatoom waaraan vier zuurstofatomen zijn gebonden. Twee van de zuurstofatomen zijn dubbel gebonden en twee zijn enkelvoudig gebonden.
Oplosbaarheid van calciumthiosulfaat
CaO3S2 is enigszins oplosbaar in water, met een oplosbaarheid van ongeveer 16 g/L bij kamertemperatuur. Het is beter oplosbaar in warm water dan in koud water. Oplosbaarheid is de maximale hoeveelheid van een stof die bij een bepaalde temperatuur en druk in een bepaald oplosmiddel kan oplossen.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 2,67 g/ml |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 152,18 g/mol |
| Dikte | 2,67 g/ml |
| Fusie punt | 155°C |
| Kookpunt | Breekt af voordat het kookt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 16 g/l bij kamertemperatuur |
| Oplosbaarheid | Enigszins oplosbaar in water |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 7.2 (dissociatie van thiozwavelzuur) |
| pH | 6,0-8,5 (1% waterige oplossing) |
Veiligheid en gevaren van calciumthiosulfaat
CaO3S2 wordt over het algemeen als veilig beschouwd als het op de juiste manier wordt behandeld en gebruikt. Bij inademing kan het echter huid- en oogirritatie en ademhalingsproblemen veroorzaken. Het kan ook gastro-intestinale irritatie veroorzaken als het wordt ingeslikt. Bij het hanteren van deze verbinding is het belangrijk om geschikte persoonlijke beschermingsmiddelen te dragen, zoals handschoenen en oogbescherming. Bij contact met de huid moet deze met veel water worden gewassen. Bij contact met de ogen minimaal 15 minuten met water spoelen. Indien ingeslikt of ingeademd, dient u onmiddellijk medische hulp te zoeken. CaO3S2 moet worden bewaard in een koele, droge, goed geventileerde ruimte, uit de buurt van onverenigbare materialen.
| Gevarensymbolen | Xi (irriterend) |
| Beveiligingsbeschrijving | Vermijd inademen van stof/rook/gas/nevel/damp/spuitnevel. Draag beschermende handschoenen/beschermende kleding/oogbescherming/gelaatsbescherming. |
| VN-identificatienummers | Niet gereguleerd |
| HS-code | 2832.10.00 |
| Gevarenklasse | 6.1 (giftig) |
| Verpakkingsgroep | III |
| Toxiciteit | LD50 (oraal, rat) 1064 mg/kg; LC50 (inhalatie, rat) >2.000 mg/m3 |
Methoden voor de synthese van calciumthiosulfaat
Er bestaan verschillende methoden om CaO3S2 te synthetiseren.
Eén methode omvat het laten reageren van calciumhydroxide (Ca(OH)2) met Na2S2O3 in water om CaO3S2 en natriumhydroxide (NaOH) te produceren.
Een andere methode is om calciumsulfaat (CaSO4) te laten reageren met natriumsulfiet (Na2SO3) en zwavel (S) in water om CaO3S2 en natriumsulfaat (Na2SO4) te produceren.
CaO3S2 kan worden verkregen door zwavel (S) en zuurstof (O2) te laten reageren met calciumoxide (CaO) of calciumcarbonaat (CaCO3) in water. Deze methode produceert CaO3S2, calciumsulfaat (CaSO4) en kooldioxide (CO2) als bijproducten.
Om CaO3S2 te synthetiseren, kan Na2S2O3 worden omgezet met calciumchloride (CaCl2) in water. Deze methode produceert CaO3S2 en natriumchloride (NaCl) als bijproducten.
Een andere methode omvat het laten reageren van calciumhydroxide (Ca(OH)2) met zwaveldioxide (SO2) en zuurstof (O2) in water, waarbij CaO3S2 en calciumsulfiet (CaSO3) als bijproducten worden geproduceerd.
Gebruik van calciumthiosulfaat
CaO3S2 heeft verschillende toepassingen in verschillende industrieën. Enkele van de toepassingen zijn onder meer:
- Landbouw – Gebruikt als meststof om planten van calcium en zwavel te voorzien.
- Fotografie – Gebruikt als fixeermiddel bij fotografische verwerking om overtollig zilverhalogenide van afdrukken en negatieven te verwijderen.
- Waterbehandeling – Gebruikt om chloor uit water te verwijderen en chloor in afvalwater te neutraliseren.
- Geneeskunde – Gebruikt als behandeling voor cyanidevergiftiging omdat het reageert met cyanide en het minder giftige thiocyanaat vormt.
- Industrieel – Gebruikt in verschillende industriële processen, zoals de productie van pulp en papier, de raffinage van aardolie en de textielverwerking.
- Voedingsindustrie – Gebruikt als voedselconserveermiddel om de groei van bacteriën te voorkomen en de versheid van voedsel te behouden.
- Diergezondheid – Gebruikt als voedingssupplement voor dieren om ze van calcium en zwavel te voorzien.
- Cosmetica – Gebruikt in cosmetica als haarconditioneringsmiddel en huidbevochtiger.
Vragen:
Vraag: Wat is beter oplosbaar in water, calciumthiosulfaat of strontiumthiosulfaat?
A: CaO3S2 is beter oplosbaar in water dan strontiumthiosulfaat.
Vraag: Welke zou volgens u beter oplosbaar zijn in water, strontiumthiosulfaat of calciumthiosulfaat?
A: CaO3S2 zou beter oplosbaar moeten zijn in water dan strontiumthiosulfaat.
Vraag: Wat is een dechloreringsatoom van calciumthiosulfaat?
A: Een CaO3S2-dechloreringsatoom bestaat uit één calciumatoom, drie zuurstofatomen, twee zwavelatomen en twee thiosulfaationen.
Vraag: Hoe calciumthiosulfaat identificeren?
A: CaO3S2 kan worden geïdentificeerd via zijn fysische en chemische eigenschappen, maar ook via verschillende analytische technieken, zoals infraroodspectroscopie en röntgendiffractie.
Vraag: Wat betekenen de cijfers in calciumthiosulfaat?
A: De cijfers in CaO3S2 verwijzen naar het aantal atomen van elk element dat in de verbinding aanwezig is. CaO3S2 geeft bijvoorbeeld aan dat er één calciumatoom, drie zuurstofatomen en twee zwavelatomen zijn.
Vraag: Wat is calciumthiosulfaatwaterbehandeling?
A: CaO3S2 wordt gebruikt bij waterbehandeling om chloor uit water te verwijderen en chloor in afvalwater te neutraliseren.
Vraag: Zijn er calciumthiosulfaattabletten?
A: Ja, CaO3S2-tabletten zijn verkrijgbaar als voedingssupplement voor dieren en voorzien hen van calcium en zwavel.
