Ethyleenglycol (C2H6O2) is een heldere, geurloze, zoet smakende vloeistof die vaak wordt gebruikt in antivriesmiddelen en andere industriële toepassingen. Het is giftig zodra het wordt ingenomen en kan ernstige gezondheidsproblemen veroorzaken.
| IUPAC-naam | Ethaan-1,2-diol |
| Moleculaire formule | C2H6O2 |
| CAS-nummer | 107-21-1 |
| Synoniemen | 1,2-Ethaandiol, Glycol, Monoethyleenglycol, MEG, Ethyleenalcohol, Hypodikoolzuur, Ethyleendihydraat |
| InChi | InChI=1S/C2H6O2/c3-1-2-4/h3-4H,1-2H2 |
Eigenschappen van ethyleenglycol
Molaire massa van ethyleenglycol
Monoethyleenglycol (MEG) heeft een molaire massa van 62,07 g/mol. Molaire massa is de massa van één mol van een stof, uitgedrukt in grammen. De molmassa van mono-ethyleenglycol kan worden gebruikt om de hoeveelheid mono-ethyleenglycol te bepalen die nodig is voor een specifieke toepassing, zoals antivries voor een voertuig.
Ethyleenglycolformule
De chemische formule voor ethyleenglycol is C2H6O2. De formule vertegenwoordigt het aantal atomen van elk element in een ethyleenglycolmolecuul. De formule van ethyleenglycol is belangrijk bij het bepalen van de eigenschappen ervan, zoals het kookpunt, het smeltpunt en de dichtheid. De formule kan ook worden gebruikt om de hoeveelheid ethyleenglycol te berekenen die nodig is voor een specifieke toepassing.
Kookpunt van ethyleenglycol
Monoethyleenglycol heeft een kookpunt van 197,3°C (387,1°F) bij atmosferische druk. Het kookpunt is de temperatuur waarbij een stof overgaat van een vloeistof naar een gas. Het hoge kookpunt van monoethyleenglycol maakt het een effectief koelmiddel en antivriesmiddel voor gebruik in auto’s en andere toepassingen.
Smeltpunt van ethyleenglycol
Monoethyleenglycol heeft een smeltpunt van -12,9°C (8,8°F). Het smeltpunt is de temperatuur waarbij een stof overgaat van een vaste naar een vloeibare toestand. Door het lage smeltpunt van monoethyleenglycol blijft het vloeibaar bij lage temperaturen, waardoor het een effectief koelmiddel is voor gebruik in koude klimaten.
Dichtheid van ethyleenglycol g/ml
De dichtheid van monoethyleenglycol is 1,11 g/ml bij 20°C (68°F). Dichtheid is de maatstaf voor de hoeveelheid massa die zich in een specifiek volume bevindt. De hoge dichtheid van monoethyleenglycol maakt het een effectief koelmiddel en antivriesmiddel voor gebruik in auto’s en andere toepassingen waar de ruimte beperkt is.
Molecuulgewicht van ethyleenglycol
Het molecuulgewicht van monoethyleenglycol is 62,07 g/mol. Het molecuulgewicht is de som van de atoomgewichten van alle atomen in een molecuul. Het molecuulgewicht van monoethyleenglycol is belangrijk bij het bepalen van de hoeveelheid monoethyleenglycol die nodig is voor een specifieke toepassing, zoals antivries voor een voertuig.
Structuur van ethyleenglycol
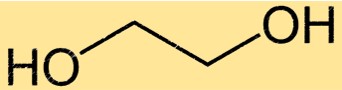
Monoethyleenglycol heeft een eenvoudige chemische structuur die bestaat uit twee hydroxylgroepen die aan een keten met twee koolstofatomen zijn bevestigd. De molecuulformule van monoethyleenglycol is C2H6O2 en de IUPAC-naam is ethaan-1,2-diol. De eenvoudige structuur van monoethyleenglycol maakt het een effectief oplosmiddel en antivriesmiddel voor gebruik in een verscheidenheid aan toepassingen.
| Verschijning | Heldere, geurloze vloeistof |
| Soortelijk gewicht | 1,113 bij 20°C |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 62,07 g/mol |
| Dikte | 1,11 g/cm³ |
| Fusie punt | -12,9°C (8,8°F) |
| Kookpunt | 197,3°C (387,1°F) |
| Flitspunt | 111°C (232°F) |
| oplosbaarheid in water | Mengbaar |
| Oplosbaarheid | Oplosbaar in aceton, alcoholen, benzeen en ether |
| Dampdruk | 0,08 mmHg bij 25°C |
| Dampdichtheid | 2,14 (lucht = 1) |
| pKa | 14,0 (eerste), 13,2 (tweede) |
| pH | Neutrale |
Veiligheid en gevaren van ethyleenglycol
Hoewel monoethyleenglycol veel praktische toepassingen heeft, brengt het ook verschillende risico’s voor de menselijke gezondheid en het milieu met zich mee. Monoethyleenglycol is zeer giftig als het wordt ingeslikt en kan ernstige gezondheidsproblemen veroorzaken, waaronder nierfalen en zelfs de dood. Inademing van mono-ethyleenglycoldampen kan irritatie van de luchtwegen en het centrale zenuwstelsel veroorzaken. Monoethyleenglycol is ook brandbaar en kan heftig reageren met bepaalde chemicaliën. Daarom moet er voorzichtig mee worden omgegaan en op de juiste manier worden bewaard. Bovendien is monoethyleenglycol schadelijk voor het waterleven en mag het niet in waterwegen of in het milieu terechtkomen. Bij het hanteren van monoethyleenglycol moeten passende veiligheidsmaatregelen worden genomen om ongelukken te voorkomen en de menselijke gezondheid en het milieu te beschermen.
| Gevarensymbolen | Schedel en gekruiste knekels, bijtend |
| Beveiligingsbeschrijving | Niet inslikken. Vermijd contact met huid en ogen. Gebruiken met voldoende ventilatie. Draag beschermende handschoenen en een veiligheidsbril. |
| VN-identificatienummers | VN 3082 |
| HS-code | 2905.32.00 |
| Gevarenklasse | 6.1 (giftig) |
| Verpakkingsgroep | II |
| Toxiciteit | Zeer giftig bij inslikken. Kan nierfalen en andere ernstige gezondheidsproblemen veroorzaken. Het inademen van dampen kan irritatie van de luchtwegen en effecten op het centrale zenuwstelsel veroorzaken. |
Methoden voor de synthese van ethyleenglycol
Er zijn verschillende methoden voor het synthetiseren van monoethyleenglycol, een sleutelelement in veel industriële processen.
Een gebruikelijke methode is de katalytische hydratatie van ethyleenoxide , waarbij ethyleenoxide met water wordt omgezet in aanwezigheid van een katalysator, zoals een sterk zuur of metaaloxide.
Een andere methode is het hydrolyseren van ethyleencarbonaat, dat wordt gevormd door ethyleenoxide te laten reageren met kooldioxide.
Een andere manier om monoethyleenglycol te synthetiseren is door ethyleen te oxideren. Het proces maakt gebruik van een zilveroxidekatalysator om ethyleen te oxideren, waarbij ethyleenoxide wordt geproduceerd, dat vervolgens hydrolyse ondergaat om monoethyleenglycol te produceren.
Om monoethyleenglycol te synthetiseren, kan oxaalzuur worden gereduceerd met waterstof, wat resulteert in de productie van glycolzuur. Vervolgens vormt dehydratatie van glycolzuur monoethyleenglycol.
Gebruik van ethyleenglycol
Monoethyleenglycol kent vele industriële en commerciële toepassingen, dankzij zijn unieke eigenschappen en veelzijdigheid. Enkele van de belangrijkste toepassingen zijn:
- Antivries: Gebruikt als koelmiddel en antivries in automobiel- en industriële toepassingen. Het lage vriespunt en het hoge kookpunt maken het een ideale keuze om motorschade door bevriezing of oververhitting te voorkomen.
- Ontdooimiddel: Wordt gebruikt als ontdooimiddel voor vliegtuigen, wegen en trottoirs, dankzij het vermogen om het vriespunt van water te verlagen.
- Oplosmiddel: Een zeer effectief oplosmiddel voor een breed scala aan stoffen, waaronder harsen, oliën en kleurstoffen. Fabrikanten gebruiken het vaak bij de productie van verven, coatings en lijmen.
- Bevochtigingsmiddel: Wordt gebruikt als bevochtigingsmiddel in de cosmetische en persoonlijke verzorgingsindustrie om vochtverlies in producten zoals lotions en shampoos te helpen voorkomen.
- Chemisch tussenproduct: Gebruikt als belangrijk tussenproduct bij de productie van een breed scala aan chemicaliën, waaronder polyestervezels en -films, polyurethaan en weekmakers.
- Warmteoverdrachtsvloeistof: Gebruikt als warmteoverdrachtsvloeistof in diverse industriële toepassingen, waaronder HVAC-systemen, zonnecollectoren en geothermische systemen.
Vragen:
Vraag: Wat is ethyleenglycol?
A: Monoethyleenglycol is een heldere, kleurloze, geurloze, zoet smakende vloeistof die vaak wordt gebruikt als koelmiddel en antivriesmiddel in automobiel- en industriële toepassingen. Het wordt ook gebruikt als oplosmiddel, bevochtigingsmiddel en chemisch tussenproduct in verschillende industrieën.
Vraag: Wat is de dampspanning van ethyleenglycol bij het normale kookpunt?
A: De dampspanning van monoethyleenglycol bij het normale kookpunt van 197,3°C (387,1°F) is 0,00131 atm.
Vraag: Is ethyleenglycol polair?
A: Ja, monoethyleenglycol is een polair molecuul vanwege de aanwezigheid van twee functionele -OH-groepen, die een dipoolmoment creëren en ervoor zorgen dat het oplost in polaire oplosmiddelen.
Vraag: Hoe meet ik de pH van ethyleenglycol?
A: De pH van monoethyleenglycol kan worden gemeten met behulp van een pH-meter of pH-indicatorstrips die speciaal zijn ontworpen voor gebruik met niet-waterige oplosmiddelen. Het is belangrijk op te merken dat monoethyleenglycol geen neutrale stof is, maar eerder een zwak zuur met een pH van ongeveer 6,5.
Vraag: Welke invloed heeft ethyleenglycol op het lichaam?
A: Monoethyleenglycol kan giftig zijn als het via de huid wordt ingenomen of geabsorbeerd, omdat het door de lever wordt gemetaboliseerd tot giftige bijproducten die nierfalen, toevallen en zelfs de dood kunnen veroorzaken. Symptomen van mono-ethyleenglycolvergiftiging zijn onder meer hoofdpijn, duizeligheid, misselijkheid, braken en verwarring.
Vraag: Welke formule vertegenwoordigt 1,2-ethaandiol?
A: De formule voor 1,2-ethaandiol, ook bekend als mono-ethyleenglycol, is C2H6O2.
Vraag: Wat zijn de projecties van Newman voor 1,2-ethaandiol?
A: Newman-projecties voor 1,2-ethaandiol laten twee verschoven conformaties zien, waarbij de -OH-groepen in een verduisterde of verschoven positie ten opzichte van elkaar zijn georiënteerd.
