IJzer(ii)sulfaat is een chemische verbinding die ijzer- en sulfaationen bevat. Het wordt vaak gebruikt bij waterbehandeling en als voedingssupplement voor planten.
| IUPAC-naam | IJzer(II)sulfaat |
| Moleculaire formule | FeSO4 |
| CAS-nummer | 7720-78-7 |
| Synoniemen | IJzersulfaat, ijzersulfaat, groen vitriool, melanteriet, szomolnokiet |
| InChi | InChI=1S/Fe.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Eigenschappen van ijzer(ii)sulfaat
IJzer(II)sulfaatformule
De chemische formule voor ijzer(II)sulfaat is FeSO4. Deze formule geeft aan dat ferrosulfaat bestaat uit één ijzeratoom, één zwavelatoom en vier zuurstofatomen. De formule van ferrosulfaat is een belangrijke parameter voor het berekenen van verschillende fysische en chemische eigenschappen van de verbinding, zoals molaire massa en molecuulgewicht.
IJzer(II)sulfaat Molaire massa
De molaire massa van ferrosulfaat is 151,91 g/mol. Deze waarde vertegenwoordigt de massa van één mol ferrosulfaat, dat 1 ijzeratoom, 1 zwavelmolecuul en 4 zuurstofmoleculen bevat. Molaire massa is een belangrijke parameter voor het berekenen van verschillende fysische en chemische eigenschappen van ferrosulfaat, zoals dichtheid en concentratie.
Kookpunt van ijzer(II)sulfaat
Ferrosulfaat heeft geen specifiek kookpunt omdat het ontleding ondergaat voordat het zijn kookpunt bereikt. Bij atmosferische druk begint het rond de 300°C te ontleden. Bij deze ontleding gaan water en zwaveltrioxide verloren, waardoor ijzer(III)oxide achterblijft. Dit ontledingsgedrag beperkt het gebruik van ferrosulfaat bij toepassingen bij hoge temperaturen.
IJzer(II)sulfaat Smeltpunt
Het smeltpunt van ferrosulfaat hangt af van de mate van hydratatie. Watervrij ijzersulfaat smelt bij 695°C, terwijl het gevormde heptahydraat smelt bij 64°C. Ferrosulfaat kan in verschillende gehydrateerde vormen voorkomen, elk met een ander smeltpunt. Het smeltpunt van ferrosulfaat is een belangrijke parameter bij het bepalen van de beste omstandigheden voor het bereiden en hanteren van de verbinding.
Dichtheid van ijzer (II) sulfaat g/ml
De dichtheid van ferrosulfaat varieert afhankelijk van de mate van hydratatie. Watervrij ijzersulfaat heeft een dichtheid van 3,65 g/ml, terwijl de heptahydraatvorm een dichtheid heeft van 1,897 g/ml. De dichtheid van ferrosulfaat is een belangrijke parameter voor het berekenen van het volume van een bepaalde massa van de verbinding.
Molecuulgewicht ijzer (II) sulfaat
Het molecuulgewicht van ferrosulfaat is 151,91 g/mol. Deze waarde vertegenwoordigt de som van de atoomgewichten van de samenstellende atomen van een ferrosulfaatmolecuul. Het molecuulgewicht is een belangrijke parameter voor het berekenen van verschillende fysische en chemische eigenschappen van ferrosulfaat, zoals kookpunt en oplosbaarheid.
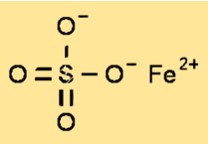
Structuur van ijzer(II)sulfaat
Ferrosulfaat heeft een kristalstructuur die behoort tot het monokliene systeem. De kristalstructuur van ferrosulfaat bestaat uit ijzer(II)kationen omgeven door zes watermoleculen en sulfaatanionen. De kristalstructuur van ferrosulfaat is een belangrijke parameter voor het begrijpen van de fysische en chemische eigenschappen van de verbinding.
| Verschijning | Wit of lichtgroen kristallijn poeder |
| Soortelijk gewicht | 3,65 g/cm3 (watervrij) |
| Kleur | Lichtgroen |
| Geur | Geurloos |
| Molaire massa | 151,91 g/mol |
| Dikte | 3,65 g/cm3 (watervrij), 1,89 g/cm3 (heptahydraat) |
| Fusie punt | 695°C (watervrij), 64°C (heptahydraat) |
| Kookpunt | Ontleedt voordat het kookpunt wordt bereikt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar |
| Oplosbaarheid | Oplosbaar in water, onoplosbaar in ethanol |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | 4 (0,1M oplossing) |
Veiligheid en gevaren van ijzersulfaat (ii)
Ferrosulfaat kan bepaalde gevaren voor de menselijke gezondheid en veiligheid met zich meebrengen. Het kan bij contact irritatie en roodheid van de huid en ogen veroorzaken, en het inademen van het stof kan irritatie van de luchtwegen veroorzaken. Inslikken kan buikpijn, misselijkheid, braken en diarree veroorzaken. Bovendien kan blootstelling aan ijzersulfaat bij daarvoor gevoelige personen beroepsastma en overgevoeligheidspneumonitis veroorzaken. Het is belangrijk om de juiste hanterings- en opslagprocedures te volgen, geschikte persoonlijke beschermingsmiddelen te dragen en het inademen of inslikken van de stof te vermijden. In geval van accidentele blootstelling dient u onmiddellijk medische hulp in te roepen en het veiligheidsinformatieblad te raadplegen voor advies.
| Gevarensymbolen | Xn, N |
| Beveiligingsbeschrijving | Verwijderd houden van vocht, zuren en oxidatiemiddelen. Vermijd contact met huid, ogen en kleding. Niet inslikken. Gebruiken met voldoende ventilatie. Na het hanteren de handen grondig wassen. |
| VN-identificatienummers | UN3077, UN1376 |
| HS-code | 2833.29.90 |
| Gevarenklasse | 9 (diverse gevaarlijke goederen) |
| Verpakkingsgroep | III |
| Toxiciteit | Schadelijk bij inslikken, veroorzaakt huid- en oogirritatie, kan irritatie van de luchtwegen veroorzaken. Kan overgevoeligheid veroorzaken bij inademing of contact met de huid. |
Methoden voor de synthese van ijzer(ii)sulfaat
Er bestaan verschillende methoden voor het synthetiseren van ferrosulfaat.
Een gebruikelijke methode omvat de reactie van ijzerafzettingen met zwavelzuur in aanwezigheid van water en zuurstof. Dit levert een ferrosulfaatheptahydraatoplossing op, die verder kan worden gezuiverd door kristallisatie.
Een andere methode omvat de reactie van ijzeroxide met zwavelzuur bij hoge temperatuur, gevolgd door afkoelen en filteren van de resulterende oplossing.
Een reductiemiddel, zoals ijzerpoeder of zwaveldioxide, kan ijzer(III)sulfaat reduceren tot ferrosulfaat. Hierbij ontstaan ijzersulfaat en zwavelzuur . Om ferrosulfaat te bereiden, kan ijzer in aanwezigheid van water worden gereageerd met zwaveldioxide en zuurstof.
Een andere methode omvat de reactie van ijzer met verdund zwavelzuur in aanwezigheid van waterstofperoxide . Hierbij ontstaat ijzersulfaat en water.
Gebruik van ijzer(ii)sulfaat
IJzer(II)sulfaat heeft een breed scala aan toepassingen in verschillende industrieën, waaronder:
- Waterbehandeling: Vaak gebruikt bij waterbehandeling om onzuiverheden, zoals waterstofsulfide, uit water te verwijderen.
- Meststoffen: Gebruikt bij de productie van meststoffen om planten te voorzien van essentiële ijzervoedingsstoffen.
- Pigmentproductie: gebruikt als voorloper voor de productie van verschillende ijzeroxidepigmenten, zoals gele en bruine pigmenten.
- Voedingssupplementen: Gebruikt als voedingssupplement voor de behandeling van bloedarmoede door ijzertekort bij mens en dier.
- Afvalwaterbehandeling: Gebruikt bij de behandeling van afvalwater om fosfaat en andere verontreinigingen te verwijderen.
- Inktproductie: gebruikt bij de inktproductie als zwartmakend middel.
- Houtconserveermiddelen: Gebruikt als houtconserveermiddel om hout te beschermen tegen schimmel- en insectenaanvallen.
- Laboratoriumreagens: Gebruikt als laboratoriumreagens bij verschillende chemische reacties en analyses.
Vragen:
Is ijzersulfaat oplosbaar in water?
A: IJzersulfaat, ook bekend als ferrosulfaat, is matig oplosbaar in water.
Vraag: Wat is de formule voor de verbinding ijzer(ii)sulfaat?
A: De formule voor ijzersulfaat is FeSO4.
Vraag: Wat is de chemische formule van ijzer(ii)sulfaat?
A: De chemische formule voor ijzersulfaat is FeSO4.
Vraag: Wat is het percentage zwavel in ijzer(ii)sulfaat?
A: Het zwavelpercentage in ferrosulfaat is 18,5%.
Vraag: Is ijzer(ii)sulfaat oplosbaar in water?
A: Ja, ijzer II-sulfaat, ook bekend als ferrosulfaat, is oplosbaar in water.
Vraag: Wat is ferrosulfaat?
A: Ferrosulfaat is een andere naam voor ferrosulfaat, een chemische verbinding die vaak in verschillende industrieën wordt gebruikt.
Vraag: Waar wordt ferrosulfaat voor gebruikt?
A: IJzersulfaat wordt voor verschillende doeleinden gebruikt, waaronder waterbehandeling, productie van kunstmest, pigmentproductie, voedingssupplementen, inktproductie, houtconserveringsmiddelen en kleurreagentia. laboratorium.
