Kaliumoxide (K2O) is een chemische verbinding bestaande uit twee kaliumatomen en één zuurstofatoom. Het wordt vaak gebruikt bij de productie van kunstmest vanwege het hoge kaliumgehalte.
| IUPAC-naam | Kaliumoxide |
| Moleculaire formule | K2O |
| CAS-nummer | 12136-45-7 |
| Synoniemen | Kalium, dikaliumoxide, kaliummonoxide |
| InChi | InChI=1S/2K.O |
Eigenschappen van kaliumoxide
Kaliumoxide-formule
De formule voor kaliumoxide is K2O. Dit betekent dat elk K2O-molecuul twee K-atomen en één O-atoom bevat. De formule voor kaliumoxide is belangrijk bij chemische berekeningen, zoals het bepalen van de molaire massa en stoichiometrie van de verbinding bij chemische reacties.
Kaliumoxide molaire massa
K2O heeft een molaire massa van 94,2 g/mol. Dit betekent dat één mol K2O 94,2 gram van de verbinding bevat. De molaire massa van een verbinding is belangrijk bij veel chemische berekeningen, zoals het bepalen van de hoeveelheid van een verbinding die nodig is voor een reactie of de massa van een monster van de verbinding.
Kookpunt van kaliumoxide
K2O heeft een hoog kookpunt van 3150 °C (5720 °F). Dit hoge kookpunt is te wijten aan de sterke ionische bindingen tussen de kalium- en zuurstofatomen van de verbinding. K2O is bij kamertemperatuur en druk een vaste stof, maar kan bij zeer hoge temperaturen verdampen tot een gas.
Smeltpunt van kaliumoxide
Het smeltpunt van K2O is 740°C (1.364°F). Dit betekent dat K2O bij temperaturen boven 740°C smelt en vloeibaar wordt. Het smeltpunt van K2O is relatief hoog vergeleken met andere ionische verbindingen, zoals natriumchloride (801°C) en magnesiumoxide (2852°C).
Dichtheid van kaliumoxide g/ml
De dichtheid van K2O bedraagt 2,32 g/cm³. Deze dichtheid is groter dan die van water (1 g/cm³) en geeft aan dat K2O een relatief dichte verbinding is. De hoge dichtheid van K2O is te wijten aan de nabijheid van de kalium- en zuurstofatomen in de kristalroosterstructuur van de verbinding.
Molecuulgewicht van kaliumoxide
Het molecuulgewicht van K2O is 94,2 g/mol. Het molecuulgewicht is de som van de atoomgewichten van alle atomen in een molecuul van de verbinding. Het molecuulgewicht van K2O is belangrijk bij stoichiometrische berekeningen, zoals het bepalen van de hoeveelheid reactanten die nodig zijn voor een chemische reactie.
Structuur van kaliumoxide
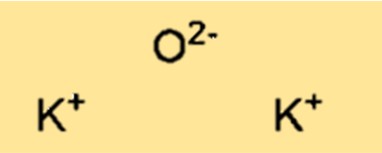
K2O heeft een kristalroosterstructuur. De structuur bestaat uit kaliumkationen (K+) en oxide-anionen (O2-) gerangschikt in een driedimensionaal herhalend patroon. De kristalroosterstructuur van K2O is belangrijk bij het bepalen van de fysische en chemische eigenschappen van de verbinding.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 2.32 |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 94,2 g/mol |
| Dikte | 2,32 g/cm³ |
| Fusie punt | 740°C (1364°F) |
| Kookpunt | 3.150°C (5.720°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Reageert hevig met water |
| Oplosbaarheid | Onoplosbaar in organische oplosmiddelen |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Niet toepasbaar |
Kaliumoxideveiligheid en gevaren
K2O brengt verschillende veiligheidsrisico’s en gevaren met zich mee. Het reageert heftig met water, waarbij een grote hoeveelheid warmte vrijkomt en kaliumhydroxide ontstaat. Deze reactie kan brandwonden en brand veroorzaken, dus het is belangrijk om voorzichtig om te gaan met K2O. Inademing of inname van K2O kan irritatie van de luchtwegen, ogen en huid veroorzaken. Bovendien kan de hoge temperatuur die nodig is om K2O te smelten of te verdampen brand- of brandgevaar veroorzaken. Daarom moet bij het hanteren van K2O geschikte beschermende uitrusting, waaronder handschoenen, een veiligheidsbril en een gasmasker, worden gedragen om deze risico’s te minimaliseren.
| Gevarensymbolen | Oxiderend, corrosief |
| Beveiligingsbeschrijving | Uit de buurt van water houden, niet inademen, beschermende uitrusting dragen |
| VN-identificatienummers | VN 2257 |
| HS-code | 2815.20 |
| Gevarenklasse | 5.1 |
| Verpakkingsgroep | II |
| Toxiciteit | Bijtend voor de huid en ogen; inademing kan irritatie van de luchtwegen veroorzaken |
Synthesemethoden voor kaliumoxide
Er zijn verschillende methoden om K2O te synthetiseren.
Een gebruikelijke methode is het verwarmen van kaliumcarbonaat, K2CO3 , op hoge temperaturen in aanwezigheid van zuurstof. Bij dit proces ontstaan K2O, kooldioxide en waterdamp.
Een andere methode omvat de reactie van metallisch kalium met zuurstofgas, waarbij K2O ontstaat en daarbij een grote hoeveelheid warmte vrijkomt.
Een reactie tussen KOH en een metaaloxide, zoals koperoxide of ijzeroxide, kan K2O produceren. De reactie produceert het overeenkomstige metaalhydroxide en K2O.
Kaliummetaal reageert met water om kaliumhydroxide en waterstofgas te produceren, wat resulteert in de synthese van K2O. Uitdroging van kaliumhydroxide leidt tot de vorming van K2O.
Bij chemische dampafzettingsmethoden introduceert de hogetemperatuurreactor een gas dat kalium en zuurstof bevat om K2O te synthetiseren. Het gas ondergaat een chemische reactie waarbij K2O ontstaat, dat op het substraatoppervlak wordt afgezet.
Gebruik van kaliumoxide
K2O heeft veel toepassingen in verschillende industrieën vanwege zijn chemische en fysische eigenschappen. Hier zijn enkele veelvoorkomende toepassingen van K2O:
- Meststofproductie: Een belangrijk element in de kunstmestproductie. Het helpt planten groeien en hun gezondheid behouden.
- Glasfabricage: Gebruikt bij de glasproductie om de smelttemperatuur te verlagen en de mechanische sterkte van glas te verbeteren.
- Metallurgie: Gebruikt in de metallurgie om metalen zoals titanium en aluminium te produceren. Dit helpt onzuiverheden te verwijderen en de algehele kwaliteit van het eindproduct te verbeteren.
- Aardolie-industrie: Gebruikt in de aardolie-industrie als katalysator bij de productie van methanol en andere chemicaliën.
- Batterijen: Batterijfabrikanten gebruiken K2O als elektrolyt bij de productie van batterijen, met name alkalibatterijen.
- Droogmiddel: Het is een krachtig droogmiddel. Wordt gebruikt om vocht te verwijderen uit materialen, zoals oplosmiddelen, brandstoffen en gassen.
- Laboratoriumreagens: Wordt ook gebruikt als laboratoriumreagens voor verschillende chemische reacties en processen.
Vragen:
Vraag: Wat is de chemische formule voor kaliumoxide?
A: De chemische formule voor kaliumoxide is K2O.
Vraag: Wat is de formule voor kaliumoxide?
A: De formule voor kaliumoxide is K2O.
Vraag: Is kaliumoxide oplosbaar in water?
A: Ja, K2O is oplosbaar in water, hoewel het krachtig reageert met water om kaliumhydroxide te produceren.
Vraag: Hoeveel gram kaliumpermanganaat is nodig om 2 g tolueen volledig te oxideren?
A: Het aantal gram kaliumpermanganaat dat nodig is om 2 g tolueen volledig te oxideren, hangt af van de reactieomstandigheden en de stoichiometrie. Een uitgebalanceerde vergelijking en reactieomstandigheden zijn nodig om de benodigde hoeveelheid kaliumpermanganaat te bepalen.
Vraag: Is K2O ionisch of covalent?
A: K2O is een ionische verbinding bestaande uit K+ kationen en O2-anionen.
Vraag: Wat is K2O?
A: K2O is de chemische formule voor kaliumoxide, een ionische verbinding met veel industriële toepassingen.
Vraag: Welk type binding is K2O?
A: De binding tussen kalium en zuurstof in K2O is ionisch.
