Calciumperoxide (CaO2) is een chemische verbinding die bij contact met water zuurstof vrijgeeft. Het wordt vaak gebruikt als oxidatiemiddel in industriële en agrarische toepassingen, waaronder bodemsanering en afvalwaterzuivering.
| IUPAC-naam | Calciumdioxide |
| Moleculaire formule | CaO2 |
| CAS-nummer | 1305-79-9 |
| Synoniemen | Calciumsuperoxide; Calciumdioxideperoxide; CP |
| InChi | InChI=1S/Ca.O2/c;1-2/q+2;-2 |
Eigenschappen van calciumperoxide
Calciumperoxide-formule
De chemische formule voor calciumperoxide is CaO2, wat aangeeft dat de verbinding één calciumatoom en twee zuurstofatomen bevat. De formule is een weergave van de samenstelling van de verbinding en is nuttig bij het bepalen van de molaire massa en andere eigenschappen van de stof. Calciumperoxide wordt vaak gebruikt als oxidatiemiddel in een verscheidenheid aan industriële en agrarische toepassingen, waaronder bodemsanering, afvalwaterzuivering en de productie van zuurstofgas.
Molaire massa calciumperoxide
De molaire massa van calciumperoxide, weergegeven door de chemische formule CaO2, is 72,077 g/mol. Molaire massa is de massa van één mol van een stof en wordt vaak gebruikt om bij chemische reacties om te rekenen tussen massa en mol. Het kennen van de molaire massa van CaO2 is nuttig bij het bepalen hoeveel van de stof nodig is voor een bepaalde reactie.
Kookpunt van calciumperoxide
CaO2 is een vaste stof en heeft geen kookpunt in de traditionele zin van het woord. In plaats daarvan ondergaat het thermische ontleding bij verhitting, waarbij zuurstofgas vrijkomt en calciumoxide achterblijft. Dit proces vindt plaats bij temperaturen boven 150°C (302°F).
Smeltpunt van calciumperoxide
Het smeltpunt van CaO2, de temperatuur waarbij het overgaat van vast naar vloeibaar, bedraagt ongeveer 350°C (662°F). Dit hoge smeltpunt is te wijten aan de sterke ionische bindingen tussen de calcium- en zuurstofatomen van de verbinding.
Dichtheid van calciumperoxide g/ml
De dichtheid van CaO2 is 2,91 g/ml. Dichtheid is een maatstaf voor de hoeveelheid massa per volume-eenheid en is nuttig bij het bepalen hoeveel ruimte een stof inneemt.
Calciumperoxide Molecuulgewicht
Het molecuulgewicht van CaO2 is 72,077 g/mol. Deze waarde wordt berekend door de atoomgewichten van alle atomen in de chemische formule van CaO2 op te tellen.
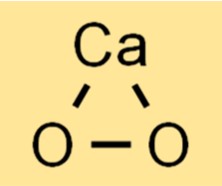
Structuur van calciumperoxide
CaO2 heeft een kristalstructuur waarin elk calciumion omgeven is door zes zuurstofatomen. De zuurstofatomen zijn gerangschikt in een tetraëdrische geometrie rond het calciumion, waarbij elke zuurstof een covalente binding vormt met het calciumion. De verbinding heeft een witte of geelachtige kleur en is onoplosbaar in water.
| Verschijning | wit poeder |
| Specifieke dichtheid | 2,91 g/cm³ |
| Kleur | Wit of geelachtig |
| Geur | Geurloos |
| Molaire massa | 72,077 g/mol |
| Dikte | 2,91 g/ml |
| Fusie punt | ~350°C (662°F) |
| Kookpunt | Ontleedt boven 150°C (302°F) |
| Flitspunt | N.v.t |
| oplosbaarheid in water | Onoplosbaar |
| Oplosbaarheid | Onoplosbaar in organische oplosmiddelen |
| Dampdruk | N.v.t |
| Dampdichtheid | N.v.t |
| pKa | N.v.t |
| pH | N.v.t |
Calciumperoxide Veiligheid en gevaren
CaO2 brengt verschillende potentiële gevaren en veiligheidsproblemen met zich mee. Het is een oxidatiemiddel en kan brand of explosies veroorzaken bij contact met organische materialen, zoals oliën of brandstoffen. Bovendien kan het heftig reageren met bepaalde zuren, zoals zoutzuur. Contact met de ogen, huid of luchtwegen kan irritatie veroorzaken, en inslikken of inademen kan ernstigere gevolgen voor de gezondheid veroorzaken. Het is belangrijk om zorgvuldig met CaO2 om te gaan en de juiste veiligheidsprocedures te volgen, inclusief het dragen van beschermende kleding en oogbescherming en het werken in een goed geventileerde ruimte.
| Gevarensymbolen | Oxidatiemiddel, Irriterend |
| Beveiligingsbeschrijving | Vermijd contact met organische materialen, Draag beschermende kleding en bril, Werk in een goed geventileerde ruimte |
| VN-identificatienummers | VN1457 |
| HS-code | 2825.90.90 |
| Gevarenklasse | 5.1 (Oxidatiemiddelen) |
| Verpakkingsgroep | III |
| Toxiciteit | Kan irritatie veroorzaken bij contact met de ogen, huid of luchtwegen. Kan ernstigere gevolgen voor de gezondheid veroorzaken bij inslikken of inademen. |
Synthesemethoden voor calciumperoxide
Er zijn verschillende methoden om CaO2 te synthetiseren.
Een gebruikelijke methode omvat de reactie van CaO met waterstofperoxide in aanwezigheid van water. Een andere methode omvat de reactie van Ca(OH)2 met waterstofperoxide . In beide gevallen is het resulterende product CaO2 en water.
Een andere methode omvat de reactie van Ca(OH)2 met natriumperoxide. Hierbij ontstaan CaO2 en natriumhydroxide.
Ook de reactie tussen CaCl2 en natriumperoxide is bekend. Hierbij ontstaan CaO2 en natriumchloride.
In het laboratorium kan CaO2 ook worden geproduceerd door de reactie van metallisch calcium met zuurstofgas. Deze methode is echter niet praktisch voor productie op grote schaal vanwege de hoge kosten van metallisch calcium.
Gebruik van calciumperoxide
CaO2 heeft vele toepassingen in verschillende sectoren. Hier zijn enkele van de meest voorkomende toepassingen:
- Landbouw: Gebruikt als zuurstofbron bij bodemsanering en als gewasconserveermiddel.
- Milieusanering: Wordt gebruikt om de bioremediatie van verontreinigde grond en water te verbeteren door te zorgen voor een langzame afgifte van zuurstof.
- Voedingsindustrie: Gebruikt als voedingsadditief om de deegkwaliteit te verbeteren en bloem witter te maken.
- Chemische synthese: Gebruikt bij de productie van verschillende chemicaliën, waaronder H2O2 en calciumstearaat.
- Polymeerproductie: gebruikt als polymeerinitiator bij de productie van polyethyleen en andere kunststoffen.
- Waterbehandeling: Gebruikt als bron van waterstofperoxide voor waterbehandeling, inclusief desinfectie en geurbestrijding.
- Mijnbouw: Gebruikt als straalmiddel bij mijnbouwactiviteiten.
- Olie- en gasindustrie: gebruikt als zuurstofbron voor verbeterde oliewinning en voor de verwijdering van sulfiden en mercaptanen uit olie- en gasstromen.
Vragen:
Vraag: Kan waterstofperoxide calciumafzettingen in het menselijk lichaam oplossen?
A: Waterstofperoxide kan in sommige gevallen effectief zijn bij het verwijderen van Ca2+-afzettingen, maar mag alleen worden gebruikt onder toezicht van een beroepsbeoefenaar in de gezondheidszorg.
Vraag: Waar komt calciumperoxide vandaan?
A: CaO2 werd voor het eerst ontdekt in het begin van de 20e eeuw door een Franse chemicus genaamd Paul Sabatier.
Vraag: Wat is calciumperoxide?
A: CaO2 is een wit of geelachtig poeder dat wordt gebruikt als zuurstofbron in verschillende industriële en ecologische toepassingen.
Vraag: Is calciumperoxidezout?
A: Nee, CaO2 is geen zout. Het is een chemische verbinding die calcium, zuurstof en soms andere elementen bevat.
Vraag: Wat is CaO2?
A: CaO2 is de chemische formule voor calciumperoxide.
Vraag: Wat betekent CaO2?
A: CaO2 is een afkorting van de chemische verbinding calciumperoxide.
