Magnesiumperoxide (MgO2) is een verbinding gemaakt van magnesium en zuurstof. Het wordt vaak in de landbouw gebruikt als bron van zuurstof met langzame afgifte en als bodemverbetering om de plantengroei te verbeteren.
| IUPAC-naam | Magnesiumperoxide |
| Moleculaire formule | MgO2 |
| CAS-nummer | 14452-57-4 |
| Synoniemen | Magnesiumdioxide, magnesium; peroxide, Permag, Magics, Oxy-Gen, EINECS 215-217-9 |
| InChi | InChI=1S/Mg.2O2/u;2*1H/q+2;;/p-2 |
Eigenschappen van magnesiumperoxide
Magnesiumperoxide-formule
De chemische formule voor magnesiumperoxide is MgO2. Dit betekent dat één molecuul magnesiumperoxide één magnesiumatoom en twee zuurstofatomen bevat. De formule is belangrijk omdat deze het type en het aantal atomen in de verbinding identificeert en helpt bij het bepalen van de stoichiometrie van chemische reacties waarbij magnesiumperoxide betrokken is.
Molaire massa van magnesiumperoxide
MgO2 heeft een molaire massa van 56.304 g/mol. Dit betekent dat één mol MgO2 56.304 gram van de verbinding bevat. De molaire massa is een belangrijke eigenschap van MgO2 omdat deze helpt bepalen hoeveel van de stof nodig is voor chemische reacties.
Kookpunt van magnesiumperoxide
MgO2 heeft geen vast kookpunt, omdat het ontleedt voordat het kan koken. Bij verhitting valt het uiteen in magnesiumoxide en zuurstofgas. Deze eigenschap van MgO2 maakt het bruikbaar als zuurstofbron in verschillende toepassingen.
Smeltpunt van magnesiumperoxide
MgO2 heeft een smeltpunt van 223°C. Dit betekent dat bij temperaturen boven de 700°C de vaste verbinding vloeibaar wordt. Het smeltpunt is een belangrijke eigenschap van MgO2 omdat het bepaalt hoe de verbinding zich gedraagt bij blootstelling aan hoge temperaturen.
Dichtheid van magnesiumperoxide g/ml
De dichtheid van MgO2 is 2,41 g/ml. Dit betekent dat één milliliter MgO2 2,41 gram weegt. Dichtheid is een belangrijke eigenschap van MgO2 omdat deze helpt bij het bepalen van de massa van een bepaald volume van de verbinding.
Magnesiumperoxide Molecuulgewicht
Het molecuulgewicht van MgO2 is 56,304 g/mol. Dit betekent dat één molecuul MgO2 een massa heeft van 56.304 atomaire massa-eenheden. Het molecuulgewicht is een belangrijke eigenschap van MgO2 omdat het helpt bepalen hoeveel van de stof nodig is voor chemische reacties.
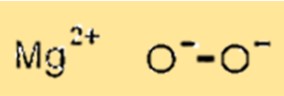
Structuur van magnesiumperoxide
MgO2 heeft een kristalstructuur waarbij magnesiumionen de octaëdrische plaatsen van de roosterstructuur bezetten en zuurstofionen de tetraëdrische plaatsen bezetten. Deze kristalstructuur is belangrijk omdat deze de fysische en chemische eigenschappen van MgO2 bepaalt.
| Eigendom | Waarde |
| Verschijning | wit poeder |
| Soortelijk gewicht | 3,15 g/cm³ |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 56,304 g/mol |
| Dikte | 2,41 g/ml |
| Fusie punt | 223°C |
| Kookpunt | Breekt af voordat het kookt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Onoplosbaar |
| Oplosbaarheid | Oplosbaar in zuren |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Niet toepasbaar |
Magnesiumperoxide Veiligheid en gevaren
MgO2 wordt over het algemeen als veilig beschouwd als het op de juiste manier wordt behandeld en gebruikt. Het kan echter irriterend zijn voor de huid, ogen en luchtwegen. Inslikken van grote hoeveelheden kan maag-darmirritatie, braken en diarree veroorzaken. Het is belangrijk om het inademen van het poeder te vermijden en beschermende kleding en uitrusting te dragen wanneer u ermee werkt. MgO2 is noch ontvlambaar noch explosief, maar kan reageren met bepaalde chemicaliën zoals zuren en sterke oxidatiemiddelen. Een juiste opslag en hantering zijn noodzakelijk om onbedoelde reacties te voorkomen. Indien blootgesteld of ingeslikt, dient u onmiddellijk medische hulp in te roepen.
| Gevarensymbolen | O, Xi |
| Beveiligingsbeschrijving | Magnesiumperoxide kan bij inademing huid- en oogirritatie en irritatie van de luchtwegen veroorzaken. Het kan schadelijk zijn bij inslikken of bij contact met de huid en kan ernstig oogletsel veroorzaken. Er bestaat ook brandgevaar als het wordt blootgesteld aan hitte, vlammen of oxidatiemiddelen. |
| VN-identificatienummers | VN1479 |
| HS-code | 282910 |
| Gevarenklasse | 5.1 |
| Verpakkingsgroep | II |
| Toxiciteit | Magnesiumperoxide kan bij inademing huid- en oogirritatie en irritatie van de luchtwegen veroorzaken. Het kan schadelijk zijn bij inslikken of bij contact met de huid en kan ernstig oogletsel veroorzaken. Er bestaat ook brandgevaar als het wordt blootgesteld aan hitte, vlammen of oxidatiemiddelen. |
Methoden voor synthese van magnesiumperoxide
Er zijn verschillende methoden voor het synthetiseren van MgO2, die elk hun voor- en nadelen hebben.
Eén methode omvat de reactie tussen MgO en waterstofperoxide . Bij deze methode meng je MgO met een kleine hoeveelheid water tot een pasta en voeg je waterstofperoxide toe terwijl je het mengsel roert. Het resulterende product is MgO2 en water.
Een andere methode omvat de reactie tussen Mg(OH)2 en waterstofperoxide . De scheikundige lost Mg(OH)2 op in water tot een oplossing, roert het mengsel en voegt langzaam waterstofperoxide toe. Het resulterende product is MgO2 en water.
Een derde methode omvat de directe reactie tussen metallisch magnesium en zuurstofgas bij hoge temperaturen. Deze methode vereist gespecialiseerde apparatuur en wordt niet zo vaak gebruikt als andere methoden.
Gebruik van magnesiumperoxide
MgO2 heeft verschillende toepassingen in verschillende industrieën, waaronder:
- Milieutoepassingen – Gebruikt als zuurstofafgevende verbinding bij bodem- en grondwatersanering om verontreinigende stoffen af te breken.
- Landbouw – Gebruikt als meststof en bodemverbeteraar vanwege de langzame zuurstofeigenschappen die de plantengroei bevorderen.
- Medisch – Wordt in sommige tandpastaformuleringen gebruikt als bleekmiddel en zuurstofvoorziening voor de mondgezondheid.
- Chemische productie – Gebruikt bij de productie van speciale chemicaliën zoals epoxy’s, perzuren en peresters.
- Voedselverwerking – Gebruikt als bleekmiddel in meel en andere voedingsproducten.
- Textielindustrie – Gebruikt als bleekmiddel bij de textielproductie.
- Waterbehandeling – Gebruikt om water te zuiveren door zuurstof vrij te geven en organische verbindingen af te breken.
Vragen:
Vraag: Waar wordt magnesiumperoxide voor gebruikt?
A: MgO2 wordt gebruikt in verschillende industrieën, zoals milieutoepassingen, landbouw, medische sector, chemische productie, voedselverwerking, textielindustrie en waterzuivering.
Vraag: Wat zijn de producten als je waterstofperoxide en magnesiumsulfaat mengt?
A: Wanneer H2O2 en magnesiumsulfaat worden gemengd, zijn de gevormde producten MgO2, water en zuurstofgas.
Vraag: Wordt magnesiumperoxide in laboratoria gebruikt?
A: Ja, MgO2 wordt in laboratoria voor verschillende doeleinden gebruikt, zoals chemische reacties, waterbehandeling en milieusanering.
Vraag: Breekt magnesium waterstofperoxide af?
A: Magnesium breekt H2O2 niet alleen af. Magnesium kan echter in aanwezigheid van een katalysator, zoals kaliumjodide, reageren met H2O2, waardoor zuurstofgas vrijkomt.
Vraag: Welke van de volgende is geen correcte formule-eenheid? k2o mgo2 al2o3 sro
A: Mgo2 is geen correcte formule-eenheid. De juiste formule-eenheid voor magnesiumoxide is MgO.
Vraag: Wat zijn de producten van deze gecombineerde reactie? mgo + co2 mgo3 + c mgco3 mgo2 mgo + o2 co2 + o2
A: Het product dat wordt gevormd bij de gecombineerde reactie van mgo en co2 is mgco3.
Vraag: Vloeibaar, gasvormig of vast Mgo2?
A: Mgo2 is een vaste verbinding.
