Kaliumsulfaat (K2SO4) is een verbinding die kalium, zwavel en zuurstof bevat. Het wordt vaak gebruikt als meststof om essentiële voedingsstoffen aan planten te leveren en de bodemkwaliteit te verbeteren.
| IUPAC-naam | Kaliumsulfaat |
| Moleculaire formule | K2SO4 |
| CAS-nummer | 7778-80-5 |
| Synoniemen | Zwavelzuur, dikaliumzout; Dikaliumsulfaat; Arcanitisch; Zwavelzuur, kaliumzout (1:2); kaliumsulfaat; sal polychrestum; geheimzinnig duplicatetum |
| InChi | InChI=1S/2K.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Eigenschappen van kaliumsulfaat
Kaliumsulfaatformule
De chemische formule voor kaliumsulfaat is K2SO4. Dit betekent dat elk kaliumsulfaatmolecuul twee kaliumatomen, één zwavelatoom en vier zuurstofatomen bevat. De kaliumsulfaatformule is nuttig voor het bepalen van de stoichiometrie van reacties waarbij de verbinding betrokken is, evenals voor het berekenen van de hoeveelheid kaliumsulfaat die nodig is voor een specifieke toepassing.
Kaliumsulfaat Molaire massa
K2SO4 heeft een molaire massa van ongeveer 174.259 g/mol. Deze waarde wordt berekend door de atoommassa’s van elk element in de verbinding op te tellen, namelijk twee kaliumatomen, één zwavelatoom en vier zuurstofatomen. Molaire massa is een bruikbare waarde voor het bepalen van de hoeveelheid K2SO4 die nodig is voor een specifieke toepassing, zoals de productie van kunstmest of laboratoriumexperimenten.
Kookpunt van kaliumsulfaat
Het kookpunt van K2SO4 is ongeveer 1.690 °C (3.074 °F). Dit is de temperatuur waarbij de verbinding overgaat van vloeistof naar gas. Het hoge kookpunt van K2SO4 maakt het bruikbaar voor toepassingen die een hoge temperatuurstabiliteit vereisen, zoals bij de productie van meststoffen en industriële chemicaliën.
Kaliumsulfaat smeltpunt
Het smeltpunt van K2SO4 is ongeveer 1,069 °C (1,956 °F). Dit is de temperatuur waarbij de vaste verbinding overgaat in de vloeibare toestand. Het relatief hoge smeltpunt van K2SO4 maakt het bruikbaar voor toepassingen bij hoge temperaturen, zoals bij de productie van glas, keramiek en kunstmest.
Dichtheid van kaliumsulfaat g/ml
De dichtheid van K2SO4 is ongeveer 2,66 g/ml bij kamertemperatuur. Dit betekent dat één milliliter K2SO4 2,66 gram weegt. De dichtheid van K2SO4 is afhankelijk van temperatuur en druk en kan worden gebruikt om de massa of het volume van de verbinding te berekenen die nodig is voor een specifieke toepassing.
Kaliumsulfaat Molecuulgewicht
Het molecuulgewicht van K2SO4 bedraagt 174.259 g/mol. Deze waarde wordt berekend door de atoomgewichten van alle elementen in de verbinding op te tellen. Het molecuulgewicht is nuttig voor het berekenen van de hoeveelheid K2SO4 die nodig is voor specifieke toepassingen, zoals in meststoffen of industriële chemicaliën.
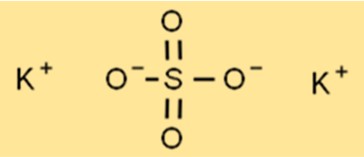
Structuur van kaliumsulfaat
De structuur van K2SO4 is een kristalroosterstructuur, waarbij elk kaliumion omgeven is door zes octaëdrische zuurstofionen. Het zwavelatoom bevindt zich in het midden van het rooster, waarbij elk zwavelatoom omgeven is door vier zuurstofionen in een tetraëdrische vorm. Deze roosterstructuur geeft K2SO4 zijn karakteristieke eigenschappen, zoals de hoge smelt- en kookpunten.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 2,66 bij 20°C |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 174.259 g/mol |
| Dikte | 2,66 g/cm³ bij 20°C |
| Fusie punt | 1069°C (1956°F) |
| Kookpunt | 1.690°C (3.074°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 111 g/l bij 20°C |
| Oplosbaarheid | Oplosbaar in water, onoplosbaar in ethanol |
| Dampdruk | 0,0 mmHg bij 25°C |
| Dampdichtheid | Niet toepasbaar |
| pKa | 1e: 2,17; 2e: 07.20 uur; 3e: 11.8 |
| pH | 5,5-8,5 (1% oplossing) |
Veiligheid en gevaren van kaliumsulfaat
K2SO4 wordt over het algemeen als veilig beschouwd voor gebruik in industriële, agrarische en laboratoriumomgevingen. De verbinding kan echter irritatie of schade aan de huid, ogen en luchtwegen veroorzaken als deze in grote hoeveelheden wordt ingenomen of ingeademd. Bovendien kan K2SO4 reageren met bepaalde chemicaliën, zoals sterke zuren, waardoor gevaarlijke dampen of branden ontstaan. Het is belangrijk om voorzichtig met K2SO4 om te gaan, de juiste beschermende uitrusting te gebruiken en de veiligheidsinstructies te volgen. Opslag van K2SO4 moet plaatsvinden in een koele, droge, goed geventileerde ruimte, uit de buurt van onverenigbare materialen.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | S24/25: Vermijd contact met huid en ogen. |
| VN-identificatienummers | VN 6066 |
| HS-code | 3104.30.00 |
| Gevarenklasse | Niet gevaarlijk voor transport |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Lage toxiciteit |
Methoden voor kaliumsulfaatsynthese
Er bestaan verschillende methoden om K2SO4 te synthetiseren.
Een gebruikelijke methode is de reactie van kaliumchloride met zwavelzuur . De reactie produceert K2SO4 en waterstofchloride als bijproduct.
Een andere methode omvat de reactie van kaliumhydroxide met zwavelzuur . Deze reactie produceert ook K2SO4 en water als bijproduct.
K2SO4 kan ook worden verkregen uit het mineraal langbeiniet, een natuurlijk mineraal dat K2SO4, magnesiumsulfaat en natriumchloride bevat. Meestal extraheren mijnwerkers het mineraal en verwerken het om onzuiverheden te verwijderen en de K2SO4 te scheiden.
Een andere methode om K2SO4 te produceren is de reactie van kaliumcarbonaat met zwavelzuur . Deze reactie produceert K2SO4 en koolstofdioxide als bijproduct.
Gebruik van kaliumsulfaat
K2SO4 heeft een breed scala aan toepassingen in diverse industrieën. Hier zijn enkele van de meest voorkomende toepassingen van K2SO4:
- Meststof: Een populaire meststof vanwege het hoge kaliumgehalte. Gebruikt bij het kweken van fruit, groenten en andere gewassen.
- Glasindustrie: Gebruikt als flux bij de glasproductie. Dit helpt het smeltpunt van glas te verlagen en de duurzaamheid ervan te verbeteren.
- Farmaceutische industrie: gebruikt als onderdeel van verschillende medicijnen, waaronder laxeermiddelen en oplossingen voor elektrolytenvervanging.
- Voedingsindustrie: Gebruikt als voedingsadditief om de zuurgraad te reguleren en als vertrekmiddel in gebak.
- Industriële toepassingen: Gebruikt in verschillende industriële toepassingen, waaronder de productie van aluminium, kaliumcarbonaat en andere chemicaliën.
- Dierenvoer: Gebruikt als voedingssupplement voor vee en pluimvee om een gezonde groei en ontwikkeling te bevorderen.
- Waterbehandeling: Gebruikt bij waterbehandeling om kalkaanslag en corrosie in ketels en andere apparatuur te beheersen.
Vragen:
Vraag: Is kaliumsulfaat oplosbaar?
A: Ja, K2SO4 is oplosbaar in water. Het heeft een oplosbaarheid van ongeveer 111 g/l bij kamertemperatuur.
Vraag: Wat zal het vaste product zijn als strontiumbromide en kaliumsulfaat reageren?
A: Wanneer strontiumbromide en K2SO4 reageren, is het gevormde vaste product strontiumsulfaat (SrSO4), een onoplosbare witte vaste stof.
Vraag: Wat wordt er nog meer geproduceerd bij de vervangingsreactie van zilvernitraat en kaliumsulfaat?
A: Bij de vervangingsreactie van zilvernitraat en K2SO4 worden ook zilversulfaat (Ag2SO4) en kaliumnitraat (KNO3) geproduceerd.
Vraag: Is kaliumsulfaat een zuur of een base?
A: K2SO4 is noch een zuur, noch een base, het is een zout. Het wordt gevormd door de neutralisatiereactie tussen een zuur (zwavelzuur) en een base (kaliumhydroxide).
Vraag: Is k2so4 oplosbaar in water?
A: Ja, K2SO4 is oplosbaar in water. Het is zeer oplosbaar en de oplosbaarheid ervan neemt toe met de temperatuur.
Vraag: Welk zout wordt geproduceerd als h2so4 reageert met naoh? k2so3 na2so4 na2so3 k2so4 A: Wanneer H2SO4 reageert met NaOH, is het geproduceerde zout Na2SO4 (natriumsulfaat) met water.
Vraag: Hoeveel mol k2so4 zit er in 15,0 g k2so4?
A: Om het aantal mol K2SO4 in 15,0 g K2SO4 te bepalen, moeten we de gegeven massa delen door de molaire massa van K2SO4, die 174,259 g/mol is. Het aantal mol K2SO4 in 15,0 g is dus 0,086 mol.
Vraag: Wat zou de formule zijn voor het neerslag dat ontstaat als pb(no3)2 (aq) en k2so4 (aq) worden gemengd?
A: Wanneer Pb(NO3)2 (aq) en K2SO4 (aq) worden gemengd, is het gevormde neerslag PbSO4 (loodsulfaat), een onoplosbare witte vaste stof. De uitgebalanceerde vergelijking voor deze reactie is Pb(NO3)2 + K2SO4 → PbSO4 + 2KNO3.
